
Inleiding
Jaarlijks wordt bij ongeveer 1300 volwassenen in Nederland een glioom gediagnosticeerd.1 Gliomen breiden zich uit in het omliggende hersenweefsel, hetgeen de behandeling bemoeilijkt. Gliomen worden onderverdeeld volgens de classificatie van de Wereldgezondheidsorganisatie (WHO), waarbij bij WHO-graad 1 en 2 sprake is van een laaggradig glioom en bij graad 3 en 4 van een hooggradig glioom.2 De prognose van het glioom is afhankelijk van de WHO-gradering, met een 1-jaars overleving van 90% bij graad 2 glioom. Hoewel curatie niet mogelijk is, heeft behandeling van glioom als doel ziekteprogressie uit te stellen met beperking van klachten door de tumor of behandeling.
Mutaties in de genen voor de enzymen isocitraatdehydrogenase 1 (IDH1) of 2 (IDH2) zijn aanwezig in bijna alle graad 2 diffuse gliomen bij volwassenen. Deze enzymen produceren de metaboliet 2-hydroxyglutaraat, die zich ophoopt in glioomweefsel, wat leidt tot diverse genetische en epigenetische veranderingen. Door hun specifieke pathogenese worden gliomen met een IDH-mutatie geclassificeerd als afzonderlijke ziekte-entiteiten volgens de meest recente WHO-classificatie.2 Gliomen met een mutatie in IDH1 of IDH2 en een ongebalanceerde translocatie tussen chromosomen 1 en 19 (1p/19q-codeletie) worden gedefinieerd als oligodendrogliomen. Gliomen met een IDH-mutatie zonder 1p/19q-codeletie worden gedefinieerd als astrocytomen.
De postoperatieve behandeling van patiënten met een hoogrisico graad 2 glioom bestaat uit een combinatie van radiotherapie en chemotherapie. Deze behandeling gaat gepaard met aanzienlijke bijwerkingen zoals stralingsgeïnduceerde neurocognitieve klachten. Om deze langdurige bijwerkingen te vermijden, kan bij patiënten met een IDH-gemuteerde graad 2 glioom na radicale resectie en zonder negatieve prognostische factoren gekozen worden om nog geen behandeling toe te passen maar te kiezen voor opvolgen met MRI-scans.
Vorasidenib is een remmer van IDH1 en IDH2, die de bloed-hersenbarrière passeert. Tijdens de eerste klinische evaluatie liet vorasidenib antitumoractiviteit zien bij patiënten met een IDH-gemuteerd glioom met een gunstig bijwerkingenprofiel.3 In een perioperatieve studie resulteerde behandeling met vorasidenib in meer dan 90% afname van de concentratie van 2-hydroxy-glutaraat in het verwijderde tumorweefsel, wat gepaard ging met omkering van ongunstige genetische en epigenetische veranderingen die typisch zijn voor IDH-mutaties bij glioom.4 In de hier te bespreken INDIGO-studie wordt het effect van vorasidenib onderzocht bij patiënten met een residuaal of gerecidiveerd glioom graad 2 met een IDH-mutatie, die alleen een resectie als eerdere behandeling hebben gehad.5 EMA heeft vorasidenib geregistreerd als behandeling van volwassenen of kinderen van 12 jaar of ouder met een graad 2 astrocytoom of oligodendroglioom met een IDH-R132- of IDH2-R172-mutatie die alleen een resectie hebben ondergaan en waarbij behandeling met radiotherapie of chemotherapie nog niet geïndiceerd is.
Kankersoort en lijn van behandeling
Eerstelijnsbehandeling met vorasidenib werd onderzocht bij patiënten met een IDH-gemuteerd graad 2 oligodendroglioom of astrocytoom die een resectie hebben ondergaan en waarbij sprake is van residuale of gerecidiveerde ziekte zonder onmiddellijke behandelindicatie.
Vergelijking met de referentiebehandeling in Nederland
In Nederland krijgen patiënten met een IDH-gemuteerd graad 2 glioom na resectie veelal niet direct aanvullende behandeling. In plaats daarvan worden zij opgevolgd met scans totdat behandeling met radiotherapie, chemotherapie of beide nodig wordt geacht op basis van risicofactoren en klachten van de patiënt. Hiermee komt de referentiebehandeling met placebo in de studie overeen met de standaardpraktijk in Nederland.
Methoden van de studie
De INDIGO-studie is een gerandomiseerde dubbelblind placebo-gecontroleerde fase III-multicenterstudie voor patiënten met gerecidiveerd of residuaal IDH-gemuteerd graad 2 glioom na resectie van de tumor. Om in aanmerking te komen voor deelname moesten patiënten 12 jaar of ouder zijn en een Karnofsky-performancestatus van 80 of hoger hebben. Patiënten mochten naast resectie geen andere behandeling voor glioom hebben ondergaan, geen glucocorticoïden gebruiken voor symptomen van glioom, en moesten geschikt worden geacht voor een afwachtend beleid. Patiënten moesten een meetbare, niet-contrast-aankleurende tumor hebben van ten minste 1 cm diameter (gemeten in de twee langste dimensies), centraal beoordeeld op basis van MRI-scans. De laatste resectie van de hersentumor diende tussen 1 en 5 jaar voor randomisatie te hebben plaatsgevonden. De IDH-mutatiestatus werd centraal bevestigd met de Oncomine Dx Target Test (Thermo Fisher Scientific). Deze test detecteert de IDH1-mutaties R132H, R132C, R132G, R132S en R132L en IDH2-mutaties R172K, R172M, R172W, R172S en R172G.
Patiënten werden 1:1 gerandomiseerd tussen behandeling met vorasidenib 40 mg of placebo eenmaal daags oraal ingenomen. De randomisatie werd gestratificeerd naar de aanwezigheid van een 1p/19q-codeletie (ja versus nee) en tumorgrootte (< 2 cm versus ≥ 2 cm). Dosisaanpassing en behandelonderbreking van vorasidenib waren toegestaan. De behandeling werd gecontinueerd tot aan ziekteprogressie, onacceptabele toxiciteit of de start van een andere oncologische behandeling. Bij ziekteprogressie kon cross-over plaatsvinden naar vorasidenib voor patiënten in de placebogroep.
Het primaire eindpunt was progressievrije overleving (PFS), geblindeerd en onafhankelijk centraal beoordeeld volgens de Response Assessment in Neuro-Oncology for Low-Grade Gliomas (RANO-LGG)-criteria.6 Secundaire eindpunten waren de tijd tot de volgende interventie (TTNI), objectieve responskans, veiligheid, kwaliteit van leven en overleving (OS). Beeldvorming middels MRI werd bij inclusie verricht, daarna elke 3 maanden gedurende 36 maanden en daarna elke 6 maanden tot progressie. Bijwerkingen van de behandeling werden geëvalueerd volgens CTC-AE 5.0. Kwaliteit van leven werd gemeten met de vragenlijsten FACT-Br en EQ-5D-5L. Data over vervolgbehandelingen zijn verzameld in deze studie. Volgens het ontwerp van beide studies waren er 340 patiënten en 164 events nodig om met 90% power en een eenzijdige alfa van 0,025 een verschil in PFS vast te kunnen stellen als de werkelijke hazard ratio (HR) 0,6 is.
Er waren 2 interim-analyses gepland. De eerste interim-analyse voor futiliteit vond plaats na het optreden van 55 PFS-events. De tweede interim-analyse was gepland na 123 PFS-events. Volgens de vooraf gespecificeerde alfa-bestedingsfunctie werd bij 123 events een PFS-verbetering in de tweede interim-analyse met p ≤ 0,00006 als statistisch significant beschouwd. Het eindpunt TTNI werd hiërarchisch getest zodra de PFS positief was.
Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
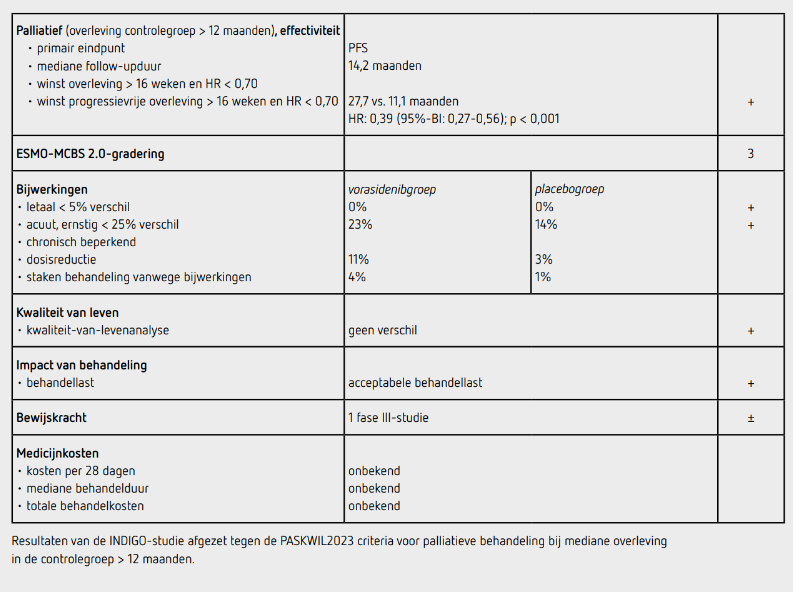
Tussen januari 2020 en februari 2022 werden 331 patiënten geïncludeerd door 77 centra in Noord-Amerika, Europa en Israël: 168 patiënten in de vorasidenibgroep en 163 in de placebogroep. De uitgangskarakteristieken in beide groepen waren vergelijkbaar: de mediane leeftijd was 40,5 jaar in de vorasidenibgroep en 39 jaar in de placebogroep, 56% was man, 53% had een Karnofsky-performancestatus van 100, 52% had een oligodendro-glioom en 83% had een tumor van minimaal 2 cm. De mediane tijd tussen de laatste resectie en inclusie in de studie was 2,4 jaar. De hier genoemde resultaten zijn van de tweede interim-analyse. De mediane follow-up was 14,2 maanden. Ten tijde van de data-cutoff werden 226 patiënten (68%) nog behandeld, 131 met vorasidenib en 95 met placebo.
Er waren 135 patiënten met ziekteprogressie, 47 in de vorasidenibgroep en 88 in de placebogroep. De PFS was significant langer in vorasidenibgroep dan in de placebogroep (HR: 0,39 [95%-BI: 0,27-0,56]; p < 0,001). De mediane PFS was 27,7 maanden (95%-BI: 17,0-niet bereikt) in de vorasidenibgroep en 11,1 maanden (95%-BI: 11,0-13,7) in de placebogroep. Het voordeel van vorasidenib op PFS leek consistent in de verschillende subgroepen, behoudens bij patiënten met een tumor kleiner dan 2 cm die minder baat leken te hebben bij behandeling met vorasidenib.
De TTNI was significant langer in de vorasidenibgroep dan in de placebogroep (HR: 0,26 [95%-BI: 0,15-0,43]; p < 0,001). De mediane TTNI was niet bereikt in de vorasidenibgroep en 17,8 maanden in de placebogroep. Er waren 18 patiënten (10,7%) met een objectieve respons in de vorasidenibgroep, waarvan 2 patiënten met een partiële respons en 16 patiënten met een beperkte respons. In de placebogroep hadden 4 patiënten (2,5%) een beperkte objectieve respons. OS-data zijn niet vermeld. Van de 167 patiënten (99%) in de vorasidenibgroep die ten minste 1 dosis medicatie ontvingen, kregen 18 patiënten (11%) ten minste 1 dosisreductie en 6 patiënten (4%) stopten de behandeling vroegtijdig vanwege bijwerkingen. Van de 163 patiënten (100%) in de placebogroep die ten minste 1 dosis medicatie ontvingen, kregen 5 patiënten (3%) een dosisreductie en stopten 2 patiënten (1%) vanwege bijwerkingen. De mediane behandelduur is niet gerapporteerd. Bijwerkingen van graad 3 of hoger kwamen voor bij 38 patiënten (23%) in de vorasidenibgroep en bij 22 patiënten (14%) in de placebogroep. De meest voorkomende bijwerking van graad 3 of hoger was een verhoogd alanine-aminotransferase (ALAT) bij 10% van de patiënten in de vorasidenibgroep. In geen van beide groepen zijn patiënten overleden aan de behandeling. Analyse van kwaliteit van leven liet een jaar na inclusie geen verandering in kwaliteit van leven ten opzichte van inclusie zien in beide groepen.7
In de vorasidenibgroep kregen 19 patiënten (11%) een vervolgbehandeling na staken van vorasidenib, waaronder chirurgie, chemotherapie of bestraling. In de placebogroep kregen 58 patiënten (36%) een vervolgbehandeling, waarvan 52 patiënten vorasidenib kregen.
Kwaliteit van de studie en interpretatie van de uitkomsten
De INDIGO-studie is een dubbelblind gerandomiseerde placebo-gecontroleerde studie. De keuze voor placebo is conform de huidige standaard waarbij een afwachtend beleid wordt gevoerd bij afwezigheid van klachten of risicofactoren. Patiënten in de placebogroep konden bij progressie behandeld worden met vorasidenib, hetgeen bij 52 van de 88 patiënten met progressie daadwerkelijk is gebeurd. Hoewel cross-over zonder reeds aangetoond effect van de interventie in principe niet geïndiceerd is, zal het de uitkomsten van deze studie niet beïnvloed hebben. De studie is immers niet gepowered op OS, en behandeling met vorasidenib na progressie op placebo was alleen toegestaan bij afwezigheid van een behandelindicatie, waardoor potentiële onderbehandeling in de placebogroep voorkomen wordt. Doordat bij het ontwerp van de studie geen formele OS-analyse gepland is, zal het onduidelijk blijven of behandeling met vorasidenib resulteert in overlevingswinst. Er waren tijdens de looptijd van de studie geen majeure wijzigingen in het protocol.
De RANO-criteria zijn de gouden standaard voor het vaststellen van respons bij hersentumoren. Desondanks kan de respons bij hersentumoren lastig zijn om vast te stellen. De centraal vastgestelde PFS kwam echter bij een sensitiviteitsanalyse goed overeen met de lokaal beoordeelde respons. De gepubliceerde resultaten zijn afkomstig van de tweede geplande interim-analyse voor PFS. In het studieprotocol staat vermeld dat bij 123 PFS events de grens voor significantie 0,00006 zou zijn. Nergens in de publicatie of de appendix staat echter vermeld wat de grens voor significatie is bij de 135 events ten tijde van deze interim-analyse. Ook staat nergens vermeld of de gerapporteerde p-waarde van < 0,001 lager is dan de grens voor effectiviteit van deze interim-analyse. Uiteindelijk konden deze getallen worden teruggevonden in het EMA-assessment report8 : de grens voor significantie van deze analyse bedraagt 0,000359 (eenzijdig) en de p-waarde van de HR van de PFS-analyse bedraagt 0,00000067. Het gevonden PFS-verschil is dus inderdaad statistisch significant. Dergelijke informatie zou niet mogen ontbreken bij de publicatie van studieresultaten in een peer-reviewed tijdschrift.
Discussie
De INDIGO-studie toonde een statistisch significant voordeel aan voor het primaire eindpunt PFS van palliatieve behandeling met vorasidenib ten opzichte van placebo bij patiënten met een IDH-gemuteerd graad 2 glioom die geen andere behandeling hadden ondergaan dan resectie van de tumor en waarbij er nog geen behandelindicatie was (HR: 0,39 [95%-BI: 0,27-0,56]; p < 0,001). De mediane PFS verbeterde met 16,6 maanden. De resultaten van dit eindpunt voldoen aan de criteria voor een positief advies volgens de PASKWIL2023-criteria voor palliatieve behandeling bij studies met een mediane overleving in de controlegroep langer dan 12 maanden.
De behandeling wordt over het algemeen goed verdragen. Graad 3 bijwerkingen worden in beperkte mate gezien en bestaan voornamelijk uit leverenzymstoornissen. Het is wel een langdurige behandeling die wordt gegeven aan patiënten waarbij normaal gesproken een afwachtend beleid wordt gevoerd. Een mogelijk voordeel van behandeling met vorasidenib ten opzichte van afwachtend beleid is dat de tijd tot radiotherapie en/of chemotherapie uitgesteld wordt, hetgeen de kwaliteit van leven van patiënten positief kan beïnvloeden omdat deze behandelingen ook aanzienlijke bijwerkingen kennen op korte en langere termijn. Voor een uiteindelijke plaatsbepaling is informatie over de kwaliteit van leven op de langere termijn van belang. Het is niet duidelijk of behandeling met vorasidenib de overleving verbetert.
Kosten
De prijs van vorasidenib is niet bekend (bron: medicijnkosten.nl d.d. oktober 2025).
Conclusie
In de hier besproken INDIGO-studie wordt bij patiënten met een IDH-gemuteerd graad 2 glioom na een mediane follow-up van 14,2 maanden een statistisch significant langere PFS gezien met palliatieve behandeling met vorasidenib dan met placebo met een toename in mediane PFS van 16,6 maanden (HR: 0,39 [95%-BI: 0,27-0,56]; p < 0,001). Deze resultaten voldoen aan de criteria voor een positief advies volgens de PASKWIL2023- criteria voor palliatieve behandeling bij studies waar de mediane overleving in de controlegroep langer dan 12 maanden is.
Referenties
- Nederlandse Kankerregistratie (cijfersoverkanker.nl).
- Louis DN, Perry A, Wesseling P et al. The 2021 WHO classification of tumors of the central nervous system: a summary. Neuro Oncol 2021;23(8):1231-51.
- Mellinghoff IK, Penas-Prado M, Peters KB et al. Vorasidenib, a dual inhibitor of mutant IDH1/2, in recurrent or progressive glioma; results of a first-in-human phase I trial. Clin Cancer Res 2021;27(16):4491-9.
- Mellinghoff IK, Lu M, Wen PY et al. Vorasidenib and ivosidenib in IDH1-mutant low-grade glioma: a randomized, perioperative phase 1 trial. Nat Med 2023;29(3):615-22.
- Mellinghoff IK, Van den Bent MJ, Blumenthal DT et al. Vorasidenib in IDH1- or IDH2- mutant low-grade glioma. N Engl J Med 2023 17;389(7):589-601.
- Van den Bent MJ, Wefel JS, Schiff D et al. Response assessment in neurooncology (a report of the RANO group): assessment of outcome in trials of diffuse lowgrade gliomas. Lancet Oncol 2011;12(6):583-93.
- Peters K, Mellinghoff I, Van den Bent M et al. A randomized, double-blind, phase 3 study of vorasidenib versus placebo in patients with mutant IDH1/2 diffuse glioma (INDIGO): Analysis of health-related quality of life, neurocognition and seizures. Neurology 2024;102(7 suppl 1):PL5.003.
- ema.europa.eu/en/documents/assessment-report/voranigo-epar-public-assessment-report_en.pdf