
Inleiding
Jaarlijks wordt in Nederland bij ongeveer 500 mensen een maligne pleuraal mesothelioom gediagnosticeerd. Het is een agressieve vorm van kanker die in de meeste gevallen irresectabel en ongeneeslijk is bij diagnose. De 5-jaarsoverleving is minder dan 10 procent. Twee belangrijke subtypen worden onderscheiden: het niet-epitheloïde en epitheloïde subtype, waarbij het niet-epitheloïde subtype een slechtere prognose heeft dan het epitheloïde subtype. De standaardbehandeling voor irresectabel mesothelioom bestaat al sinds jaren uit 4-6 kuren platinum en pemetrexed, met een mediane overleving van 12 maanden.1 Recent is toegevoegd als mogelijke eerstelijnsbehandeling van patiënten met irresectabel maligne pleuraal mesothelioom de combinatie van nivolumab en ipilimumab, waarbij dit met name beter lijkt bij de niet-epitheloïde variant.2
1. Kankersoort en lijn van behandeling
Eerstelijnsbehandeling met vervolgens onderhoudsbehandeling met gemcitabine na minimaal 4 kuren platinum en pemetrexed werd onderzocht bij onbehandelde patiënten met een irresectabel maligne pleuraal mesothelioom.
2. Vergelijking met de referentiebehandeling in Nederland
In de NVALT19-studie3 wordt palliatieve behandeling met onderhoudsbehandeling gemcitabine vergeleken met best supportive care na minimaal 4 kuren platinum en pemetrexed. Dit was de standaard eerstelijnsbehandeling in Nederland ten tijde van de studie.
3. Methode en kwaliteit van de studie
De NVALT19-studie is een gerandomiseerde fase II-multicenterstudie (open label) voor patiënten met histologisch bewezen, irresectabel, maligne pleuraal mesothelioom. Om voor inclusie in aanmerking te komen dienden patiënten ten minste 18 jaar te zijn, minimaal 4 kuren platinum (cisplatine of carboplatine) en pemetrexed te hebben gehad als eerstelijnsbehandeling ten minste 21 maar maximaal 42 dagen voor start studie, een ECOG-performancestatus van 0-2, en een adequate orgaan- en beenmergfunctie te hebben. Daarnaastmoest er meetbare of evalueerbare ziekte zijn volgens modified RECIST (mRECIST) voor mesothelioom. De belangrijkste exclusiecriteria waren symptomatische hersenmetastasen, radiotherapie binnen 2 weken voor start van de studie en ernstige comorbiditeit (zoals niet voldoende gereguleerde diabetes mellitus, ernstig hartfalen [NYHA III of IV]). Patiënten werden 1:1 gerandomiseerd tussen behandeling met gemcitabine 1250 mg/m2 op dag 1 en 8 van een 3-wekelijks schema of best supportive care (BSC).
Behandeling werd gegeven tot progressie, onacceptabele toxiciteit of medische noodzaak tot andere antitumorbehandeling (behoudens palliatieve radiotherapie). De randomisatie werd gestratificeerd voor histologie (epitheloïd versus niet-epitheloïd), respons op eerstelijns behandeling (complete of partiële respons versus stabiele ziekte) en studiecentrum. Randomisatie vond plaats na voltooien van de eerstelijnsbehandeling. Het primaire eindpunt van de studie was progressievrije overleving (PFS), gemeten volgens mRECIST en bepaald door de lokale behandelaar. Secundaire eindpunten waren naast overleving (OS) onder andere objectieve radiologische respons (ORR), verandering van de longfunctie in de tijd, en bijwerkingen. Een CT-scan voor responsevaluatie werd gemaakt voor start en elke 6 weken gedurende de studie. Alle CT-scans werden tevens beoordeeld door een onafhankelijke radioloog. Bijwerkingen van de behandeling werden geëvalueerd volgens CTC-AE 4.0.
Het primaire eindpunt werd bepaald op de intention to treat-populatie. Er was berekend op basis van data uit de NVALT5-studie dat 118 PFS events nodig waren om met een power van 90 procent een hazard ratio (HR) van 0,58 te detecteren met een tweezijdige alfa van 0,10. De studie is opgezet als voorwerk voor een grotere fase III-studie. Deze is tot op heden niet geïnitieerd.
4. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
Tussen maart 2014 en februari 2019 werden 130 patiënten geïncludeerd door 18 centra uit Nederland: 65 patiënten werden gerandomiseerd in de gemcitabinegroep en 65 patiënten in de controlegroep. Op het moment van data-analyse hadden 125 van 130 patiënten ziekteprogressie of waren overleden ten gevolge van de ziekte. De mediane follow-up was 36,5 maanden (95%-BI: 34,2-niet behaald). De uitgangskarakteristieken in de beide behandelgroepen waren vergelijkbaar, de mediane leeftijd was 69 jaar, 89 procent respectievelijk 83 procent was man en 88 procent van de patiënten had een epitheloïd mesothelioom. Meetbare ziekte was aanwezig bij 74 procent versus 77 procent van de patiënten.
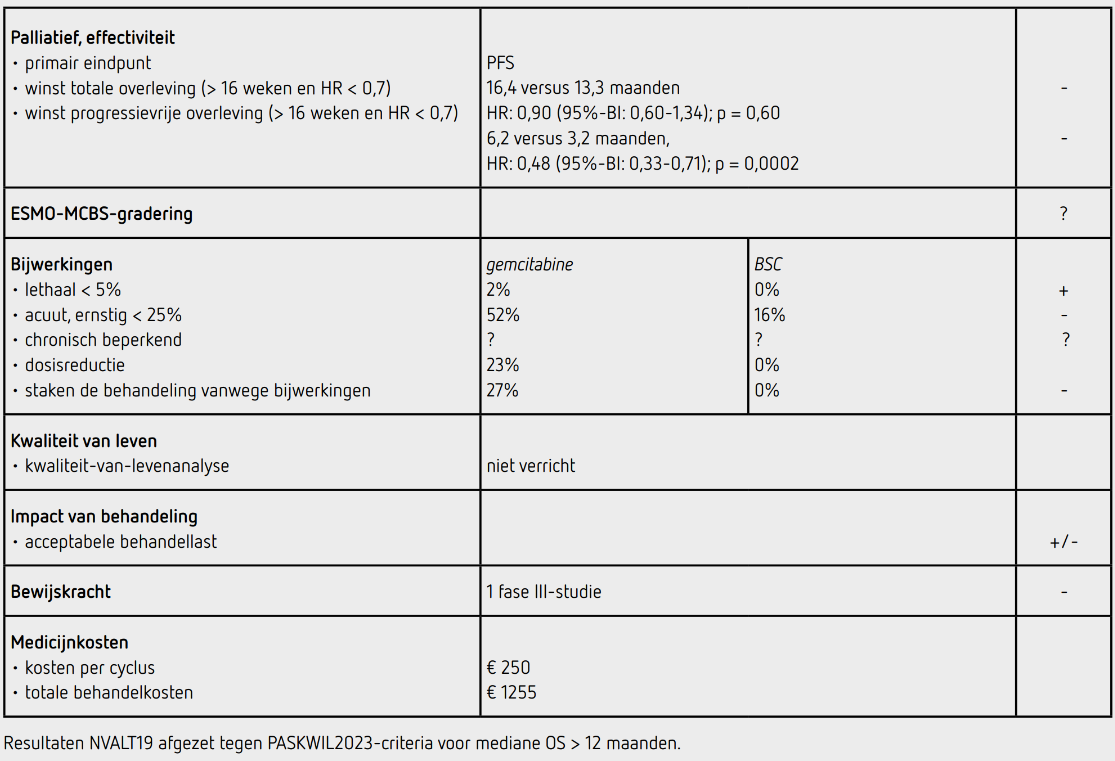
De mediane PFS was 6,2 maanden (95%-BI: 4,6-8,7) in de gemcitabinegroep en 3,2 maanden (95%-BI: 2,8-4,1) in de controlegroep (HR: 0,48 [95%-BI: 0,33-0,71]; p = 0,0002). Deze data werden bevestigd door onafhankelijke beoordeling met een mediane PFS van 5,3 maanden (95%-BI: 4,2-7,1) in de gemcitabinegroep en 2,8 maanden (95%-BI: 2,5-3,2) in de controlegroep, HR: 0,49 [95%-BI: 0,33-0,72]. Een objectieve radiologische respons werd vastgesteld bij 8 van de 48 patiënten (17 procent) met meetbare ziekte in de gemcitabinegroep en 2 van de 50 (4 procent) in de controlegroep. Bij de onafhankelijkebeoordeling werd dit bijgesteld naar respectievelijk 11 procent en 2 procent. Op moment van analyse waren 102 van de 130 patiënten overleden (78 procent). De mediane OS was 16,4 maanden (95%-BI: 11,6-20,2) in de gemcitabinegroep en 13,4 maanden (95%-BI: 12,4-17,8) in de controlegroep (HR: 0,90 [95%-BI: 0,60-1,34]; p = 0,60). Na progressie kreeg 61 procent van de patiënten in de gemcitabinegroep een volgende lijn systemische behandeling waarbij nivolumab het meest frequent werd gegeven (28 procent). In de controlegroep kreeg 72 procent van de patiënten een vervolgbehandeling waarbij gemcitabine het meest gekozen werd (31 procent).
In de gemcitabinegroep kregen 64 patiënten minimaal 1 dosis. Een dosisreductie vond plaats bij 15 patiënten (23 procent), 39 patiënten (61 procent) sloegen één of meerdere doses over, uitstel van dosis trad op bij 27 patiënten (42 procent) en 17 patiënten (27 procent) stopten de behandeling vanwege bijwerkingen. Bijwerkingen van graad 3 of 4 traden op bij 33 van de 64 patiënten (52 procent) in de gemcitabinegroep en 10 van de 62 evalueerbare patiënten (16 procent) in de controlegroep. De meest voorkomende bijwerkingen van graad 3 of 4 waren neutropenie (33 procent versus 0 procent), infectie (13 procent versus 3 procent) en cardiovasculaire aandoeningen (11 procent versus 2 procent). Er overleed 1 patiënt in de gemcitabinegroep aan bijwerkingen (infectie). Veranderingen in longfunctie of gewicht verschilden niet tussen de groepen in de tijd. Er zijn geen kwaliteit-van-levendata verzameld.
Discussie
In de NVALT19-studie wordt een statistisch significant voordeel aangetoond voor het primaire eindpunt PFS van eerstelijns palliatieve behandeling met gemcitabineonderhoud ten opzichte van best supportive care bij patiënten met een irresectabel maligne pleuraal mesothelioom met een goede ECOG-performancestatus (HR: 0,48 [95%-BI: 0,33-0,71]; p = 0,0002). De mediane PFS werd verlengd met 3 maanden. De PFS-verlenging van gemcitabine-onderhoud ten opzichte van best supportive care voldoet niet aan de PASKWIL2023-criteria voor palliatieve behandeling bij studies waarin de mediane overleving in de controlegroep langer dan 12 maanden is.
Het bijwerkingenprofiel van gemcitabine-onderhoud is verschillend ten opzichte van best supportive care, met in de gemcitabinegroep meer chemotherapiegerelateerde toxiciteit en veel patiënten die de behandeling staakten vanwege bijwerkingen. Er wordt geen verschil in overleving aangetoond. Een mogelijke verklaring hiervoor is dat een aanzienlijk deel van de patiënten in de controlegroep na progressie gemcitabine kreeg. In de huidige richtlijn mesothelioom wordt aangegeven dat gemcitabine een rationele behandeloptie kan zijn in de tweede of derde lijn met als argument dat er een beperkt aantal effectieve behandelopties voor mesothelioompatiënten is. De toxiciteit is hanteerbaar en de lage kosten zijn overwegingen om gemcitabine voor te schrijven aan patiënten die tweede- of derdelijns therapie wensen of patiënten die niet in aanmerking komen voor de standaard chemotherapiebehandeling (door bijvoorbeeld een matige nierfunctie). Aangezien gemcitabine geen standaardbehandeling is, dienen de overwegingen voor de keuze voor gemcitabine met de patiënt besproken en vastgelegd te worden (shared decision making). De NVALT19-studie laat opnieuw zien dat het in Nederland mogelijk is een goed opgezette en uitgevoerde studie te doen in een relatief zeldzaam tumortype.
5. Kosten
De mediane behandelduur was 15 weken, oftewel 5 cycli gemcitabine. Uitgaande van twee doses van 2500 mg gemcitabine per keer (2,0 m2 x 1250 mg/m2) kost de behandeling 250 euro per cyclus (bron: medicijnkosten.nl d.d. 26 december 2023). De totale medicatiekosten bij een mediane behandelduur van 15 weken (5 cycli, 10 toedieningen) komen daarmee op 1255 euro.
Conclusie
In de hier besproken NVALT19-studie wordt bij patiënten met irresectabel maligne pleuraal mesothelioom na een follow-up van mediaan 36,5 maanden een statistisch significant langere PFS gezien voor onderhoudsbehandeling met gemcitabine ten opzichte van de controlegroep (HR: 0,48 [95%-BI: 0,33-0,71]) met een verlenging van de mediane PFS van 13 weken. Deze resultaten voldoen niet aan de criteria voor een positief advies volgens de PASKWIL2023-criteria voor een palliatieve behandeling bij studies waarin de mediane overleving in de controlegroep langer dan 12 maanden is.

Referenties
- Vogelzang NJ, Rusthoven JJ, Symanowski J, et al. Phase III study of pemetrexed in combination with cisplatin versus cisplatin alone in patients with malignant pleural mesothelioma. J Clin Oncol. 2003;21(14):2636-44.
- Baas P, Scherpereel A, Nowak AK, et al. First-line nivolumab plus ipilimumab in unresectable malignant pleural mesothelioma (CheckMate 743): A multicentre, randomised, open-label, phase 3 trial. Lancet. 2021;397(10272):375-86.
- de Gooijer CJ, van der Noort V, Stigt JA, et al. Switch-maintenance gemcitabine after first-line chemotherapy in patients with malignant mesothelioma (NVALT19): An investigator-initiated, randomised, open-label, phase 2 trial. Lancet Respir Med. 2021;9(6):585-92