
Inleiding
Ruim twee derde van de patiënten met een mammacarcinoom heeft hormoonreceptorpositieve (HR-positieve), humaan epidermaal groeifactorreceptor 2-negatieve (HER2-negatieve) ziekte.1 Bij patiënten met gemetastaseerd HR-positief, HER2-negatief mammacarcinoom bestaat in Nederland de standaard eerstelijnstherapie uit antihormonale therapie, gevolgd door endocriene therapie met een CDK4/6-remmer in de tweede lijn. Resistentie tegen endocriene behandeling is een belangrijk probleem. Een van de mechanismen die hieraan bijdraagt, is het ontstaan van mutaties in de oestrogeenreceptor 1 (ESR1). Dergelijke mutaties veroorzaken oestrogeen onafhankelijke activatie van de oestrogeenreceptor (ER) waardoor er resistentie ontstaat tegen onder andere aromataseremmers.2 Elacestrant is een orale, selectieve ER ‘degrader’ (SERD), die ook actief is bij ESR1-mutaties. In de hier te bespreken EMERALD-studie wordt behandeling met elacestrant vergeleken met standaard endocriene therapie bij patiënten met een lokaal gevorderd of gemetastaseerd ER-positief, HER2-negatief mammacarcinoom met of zonder een ESR1-mutatie die eerder behandeld zijn met 1 of 2 lijnen endocriene therapie waaronder een CDK4/6remmer en maximaal 1 lijn chemotherapie.3 EMA heeft elacestrant geregistreerd voor patiënten met een lokaal gevorderd of gemetastaseerd ER-positief, HER2-negatief mammacarcinoom en een activerende ESR1-mutatie en voorbehandeling met minimaal 1 lijn endocriene therapie, waaronder een CDK4/6-remmer.
1. Kankersoort en lijn van behandeling
Behandeling met elacestrant werd onderzocht bij patiënten met een lokaal gevorderd of gemetastaseerd ER-positief, HER2-negatief mammacarcinoom die eerder behandeld werden met 1 of 2 lijnen palliatieve endocriene therapie waaronder een CDK4/6-remmer en maximaal 1 lijn chemotherapie.
2. Vergelijking met de referentiebehandeling in Nederland
In de EMERALD-studie wordt behandeling met elacestrant vergeleken met standaardzorg endocriene therapie. In deze studie bestond standaardzorg uit fulvestrant dan wel een aromataseremmer, met een voorkeur voor het middel dat nog niet gegeven was voor gemetastaseerde ziekte. In Nederland wordt bij deze patiëntengroep in de eerste lijn meestal een aromataseremmer gestart. In de tweede lijn wordt in het algemeen een CDK4/6-remmer toegevoegd aan endocriene behandeling met fulvestrant. Na progressie op een CDK4/6-remmer wordt meestal gekozen voor endocriene therapie die de patiënt nog niet gehad heeft, of in geval van een PIK3CA-mutatie voor alpelisib met fulvestrant4, of chemotherapie. Hiermee is de controlegroep grotendeels vergelijkbaar met de referentiebehandeling in Nederland.
3. Methode en kwaliteit van de studie
De EMERALD-studie is een gerandomiseerde, open-label, fase III-multicenterstudie voor postmenopauzale vrouwen, of mannen, met een lokaal gevorderd of gemetastaseerd ER-positief, HER2-negatief mammacarcinoom. Om voor inclusie in aanmerking te komen dienden patiënten 18 jaar of ouder te zijn en een ECOG-performancestatus van 0 of 1 en een pathologisch bewezen gemetastaseerd ER-positief, HER2-negatief mammacarcinoom te hebben. ER-positief was gedefinieerd als ≥ 1 procent aankleurende tumorcellen bij immuunhistochemie. Er moest meetbare ziekte zijn volgens RECIST1.1, of ten minste een duidelijk lytische ossale haard. Daarnaast diende er ziekteprogressie te zijn na 1 of 2 lijnen endocriene therapie voor gemetastaseerde ziekte. Een van de eerdere behandellijnen moest bestaan uit een CDK4/6-remmer, in combinatie met een aromataseremmer of fulvestrant. Progressie gedurende of binnen 12 maanden na adjuvante endocriene therapie telde als een behandellijn. Eén behandellijn met palliatieve chemotherapie was toegestaan. Patiënten met symptomatische viscerale ziekte of met een ernstig cardiovasculair event in de voorgaande 6 maanden werden geëxcludeerd.
Patiënten werden 1:1 gerandomiseerd tussen behandeling met elacestrant 400 mg eenmaal daags en standaardzorg. Standaardzorg bestond uit behandeling met fulvestrant, anastrozol, letrozol of exemestaan monotherapie, naar keuze van de behandelaar. Hierbij werd aanbevolen om een middel te geven dat de patiënt nog niet had gehad, waarbij met name fulvestrant de voorkeur had als dit nog niet gegeven was. De behandeling werd gestratificeerd naar de aanwezigheid van een ESR1-mutatie (ja versus nee), de aanwezigheid van viscerale metastasen (ja versus nee) en eerdere behandeling met fulvestrant (ja versus nee). Dosisaanpassing van elacestrant en behandelonderbreking was toegestaan.
De behandeling werd gecontinueerd tot aan ziekteprogressie, onacceptabele toxiciteit of stoppen op verzoek van patiënt. Ziekteprogressie werd beoordeeld op basis van beeldvorming volgens RECIST 1.1. Evaluatie van ESR1-mutaties werd gedaan in circulerend celvrij DNA, dat centraal werd bepaald en waarvan de resultaten niet werden gedeeld met de lokale onderzoekers.
Het primaire eindpunt van de studie was progressievrije overleving (PFS) in alle patiënten, en in patiënten met een ESR1-mutatie. Secundaire eindpunten waren onder andere overleving (OS) in alle patiënten en in patiënten met een ESR1-mutatie, PFS beoordeeld door de onderzoeker, responskans, veiligheid en kwaliteit van leven.
Een CT- of MRI-scan voor evaluatie werd elke 8 weken gemaakt. Bij patiënten met botmetastasen werd elke 24 weken een botscan of whole body MRI gemaakt. Bijwerkingen van de behandeling werden geëvalueerd volgens CTC-AE 5.0. Kwaliteit van leven werd gemeten met behulp van de vragenlijsten EQ-5D-5L, EORTC QLQ-C30 en PRO-CTCAE.
Volgens het ontwerp van de studie waren er 466 patiënten en 340 events nodig om met 92 procent power en een tweezijdige alfa van 2,5 procent een hazard ratio (HR) van 0,667 voor progressie vast te kunnen stellen voor de hele populatie. Er waren 220 patiënten met een ESR1-mutatie nodig en 160 events om met 80 procent power en een tweezijdige alfa van 2,5 procent een HR van 0,610 voor progressie in dit cohort te kunnen vaststellen. Dit komt overeen met een geschatte toename in mediane PFS bij patiënten met een ESR1-mutatie in de controlegroep van 5,3 maanden naar 8,7 maanden in de elacestrantgroep. Ten tijde van de finale PFS-analyse vond een interim-analyse plaats van OS met een gealloceerde tweezijdige alfa van 0,01 procent. De finale OS-analyse zal plaatsvinden zodra 50 procent van de patiënten is overleden.
4. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
Tussen februari 2019 en oktober 2020 werden 477 patiënten geïncludeerd door 228 centra in 17 landen in Noord- en Zuid-Amerika, Europa, en Azië: 239 patiënten in de elacestrantgroep en 238 patiënten in de controlegroep. De mediane follow-up bedroeg 15,1 maanden. De uitgangskarakteristieken in de beide behandelarmen waren vergelijkbaar: de mediane leeftijd was 63 jaar, de ECOG-performancestatus was 0 bij bijna 60 procent van de patiënten, circa 70 procent had viscerale metastasen, 43 procent was behandeld met 2 eerdere lijnen endocriene therapie voor gemetastaseerde ziekte. 80 procent van de patiënten had eerder behandeling met een aromataseremmer gehad en 30 procent behandeling met fulvestrant. 22 procent had 1 lijn palliatieve chemotherapie gehad. In totaal hadden 228 patiënten (48 procent) een ESR1-mutatie. Er participeerden 7 mannen (1,4 procent).
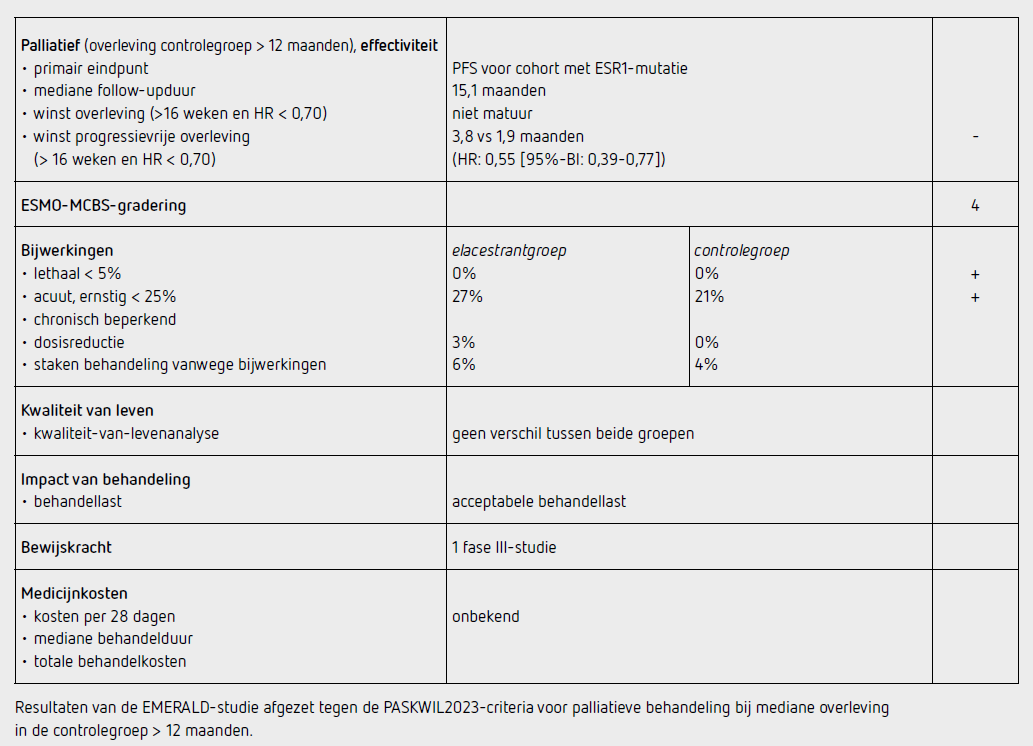
In de controlegroep werden 165 patiënten (69 procent) behandeld met fulvestrant en 73 (31 procent) met een aromataseremmer. Het is niet bekend hoeveel patiënten in de controlegroep reïntroductie kregen van een middel waar ze eerder mee behandeld waren. Ten tijde van de data cutoff (6 september 2021) waren 442 patiënten gestopt met de behandeling, 219 in de elacestrantgroep en 223 in de controlegroep. Het primaire eindpunt PFS in de intention to treat-populatie was statistisch significant beter in de elacestrantgroep dan in de controlegroep (HR: 0,70 [95%-BI: 0,55-0,88]; p = 0,002). De mediane PFS bedroeg 2,8 maanden in de elacestrantgroep en 1,9 maanden in de controlegroep.
De 1-jaars PFS was 22,3 procent in de elacestrantgroep en 9,4 procent in de controlegroep. In de populatie met een ESR1-mutatie was de PFS ook significant beter in de elacestrantgroep dan in de controlegroep (HR: 0,55 [95%-BI: 0,39-0,77]; p = 0,0005). De mediane PFS bedroeg in dit cohort 3,8 maanden in de elacestrantgroep en 1,9 maanden in de controlegroep, en de 1-jaars PFS was respectievelijk 26,8 procent en 8,2 procent. Bij de interim-analyse van het secundaire eindpunt OS hadden 149 overlijdens plaatsgevonden in de ITT-populatie, 70 in de elacestrantgroep en 79 in de controlegroep. In het cohort met een ESR1-mutatie waren 68 patiënten overleden, 28 in de elacestrantgroep en 40 in de controlegroep. Er was geen significant verschil in het risico op overlijden in de ITT-populatie (HR: 0,75 [95%-BI: 0,54-1,04]; p = 0,08) en in de populatie met een ESR1-mutatie (HR: 0,59 [95%-BI: 0,36-0,96]; p = 0,03, niet significant bij een voor deze interim-analyse gestelde alfa van 0,0001). In de elacestrantgroep was de objectieve responskans 4,5 procent en in de controlegroep 4,4 procent in de totale populatie, en 7,1 versus 4,7 procent in het cohort met een ESR1-mutatie.
Van de 237 patiënten (99 procent) in de elacestrantgroep die ten minste 1 dosis medicatie ontvingen, kregen 7 patiënten (3 procent) ten minste 1 dosisreductie. Elacestrant werd voortijdig gestaakt vanwege bijwerkingen door 15 patiënten (6 procent). Bij de 229 patiënten (96 procent) in de controlegroep die ten minste 1 dosis medicatie ontvingen, werden geen dosisreducties toegepast en staakten 10 patiënten (4 procent) de behandeling voortijdig vanwege bijwerkingen. In totaal hadden 64 patiënten (27 procent) behandeld in de elacestrantgroep ten minste 1 bijwerking van graad 3 of hoger ten opzichte van 47 patiënten (21 procent) in de controlegroep. Er zijn geen patiënten overleden als gevolg van bijwerkingen van de behandeling. De meest voorkomende bijwerkingen van graad 3 of 4 in de elacestrantgroep en in de controlegroep waren misselijkheid (2,5 versus 0,9 procent) en rugpijn (2,5 versus 0,4 procent).
Analyses van kwaliteit van leven zijn apart gerapporteerd en tonen voor de elacestrantgroep ten opzichte van de controlegroep geen relevante verschillen.5
Discussie
De EMERALD-studie toont een statistisch significante verlenging van de mediane PFS met 0,9 maanden in de totale populatie van postmenopauzale vrouwen of mannen met een lokaal gevorderd of gemetastaseerd ER-positief, HER2-negatief mammacarcinoom (HR: 0,70 [95%-BI: 0,55-0,88]; p = 0,002), die behandeld worden met elacestrant na eerdere endocriene therapie waaronder een CDK4/6-remmer ten opzichte van controlebehandeling.
In het vooraf gedefinieerde cohort met een ESR1-mutatie verbeterde de PFS met 1,9 maanden (HR: 0,55 [95%-BI: 0,39-0,77]; p = 0,0005). De EMA heeft elacestrant alleen geregistreerd voor patiënten met een ESR1-mutatie. Bij de eerste interim-analyse werd geen significante OS-winst aangetoond. De overlevingscijfers zijn echter nog niet matuur. Deze resultaten voldoen niet aan de criteria voor een positief advies volgens de PASKWIL2023-criteria voor palliatieve behandeling bij studies waar de mediane overleving in de controlegroep langer dan 12 maanden is.
In Nederland wordt een CDK4/6-remmer meestal pas als tweedelijns behandeling gegeven naast fulvestrant. De gebruikte controlebehandeling in deze studie bestond uit monotherapie fulvestrant of een aromataseremmer, middelen die de meeste patiënten in Nederland reeds eerder gehad zullen hebben, en beperkt effectief zijn bij reïntroductie. Er heeft geen vergelijking plaatsgevonden met alpelisib/fulvestrant wat in de derde lijn overwogen kan worden bij patiënten met een PIK3CA-mutatie of met chemotherapie. Bovendien is niet vermeld hoeveel patiënten reïntroductie hebben gekregen van een middel waar eerder progressie bij optrad. Elacestrant is een middel met beperkte toxiciteit en de bijwerkingen zijn niet duidelijk verschillend van andere endocriene middelen. Het bepalen van mutaties in circulerend celvrij DNA zoals in deze studie gedaan is voor het vaststellen van een ESR1-mutatie, is een techniek die in de dagelijkse predictieve diagnostiek nog niet gangbaar is.
5. Kosten
De kosten van deze behandeling zijn nog niet bekend.
Conclusie
In de hier besproken EMERALD-studie wordt bij patiënten met een lokaal gevorderd of gemetastaseerd ER-positief, HER2-negatief mammacarcinoom die eerder behandeld zijn met minimaal 1 lijn endocriene therapie waaronder een CDK4/6-remmer, een statistisch significant langere maar zeer beperkte mediane PFS-winst gezien met elacestrant ten opzichte van endocriene therapie. De EMA heeft elacestrant alleen geregistreerd voor patiënten met een ESR1-mutatie. Bij patiënten met een ESR1-mutatie verbeterde de mediane PFS van 1,9 naar 3,8 maanden (HR: 0,55 [95%-BI: 0,39-0,77]; p = 0,0005). De OS-data zijn nog niet matuur. Dit resultaat voldoet niet aan de criteria voor een positief advies volgens de PASKWIL2023-criteria voor palliatieve behandeling bij studies waar de mediane overleving in de controlegroep langer dan 12 maanden is.
Referenties
- Nederlandse Kankerregistratie (cijfersoverkanker.nl). Integraal Kankercentrum Nederland.
- Burstein HJ. Systemic therapy for estrogen receptor-positive, HER2-negative breast cancer. N Engl J Med 2020;383(26):2557-70.
- Bidard FC, Kaklamani VG, Neven P et al. Elacestrant (oral selective estrogen receptor degrader) versus standard endocrine therapy for estrogen receptor-positive, human epidermal growth factor receptor 2-negative advanced breast cancer: Results from the randomized phase III EMERALD trial. J Clin Oncol 2022;40(28):3246-56.
- Plaatsbepaling richtlijncommissie: opties voor behandeling van het HR-positief mammacarcinoom. MedOncol 2020;23(9):23-7.
- Cortés J, Bidard FC, Bardia A, et al. EMERALD trial analysis of patient-reported outcomes (PROs) in patients with ER+/HER2L advanced or metastatic breast cancer (mBC) comparing oral elacestrant vs standard of care (SoC) endocrine therapy. ESMO open 2023;8(1S4, abstr 1880) doi.org/10.1016/j.esmoop.2023.101377.