
Inleiding
Het nasopharynxcarcinoom is zeldzaam en wordt in Nederland jaarlijks bij ongeveer 150 patiënten vastgesteld. Er zijn echter gebieden in Zuidoost-Azië, Indonesië, rond de Middellandse Zee en in het poolgebied waar het nasopharynxcarcinoom endemisch voorkomt. Er lijkt een relatie te bestaan met etniciteit en omgevingsfactoren zoals voeding en rookgewoontes. Daarnaast kunnen bepaalde subtypen van het nasopharynxcarcinoom gerelateerd zijn aan een infectie met het epstein-barrvirus. Er zijn vier subtypen: het keratiniserende plaveiselcelcarcinoom (WHO type I), de niet-keratiniserende gedifferentieerde vorm (WHO type II) of ongedifferentieerd carcinoom (WHO type III). Het basaloïd plaveiselcelcarcinoom is het vierde, uiterst zeldzame, subtype. De ziekte kan zich op alle leeftijden voordoen en komt 23 keer vaker voor bij mannen dan bij vrouwen. Het niet-keratiniserende lokaal gevorderde nasopharynxcarcinoom heeft een sterke neiging tot metastaseren. Gerecidiveerde of gemetastaseerde ziekte wordt behandeld volgens de Europese richtlijnen (ESMO-EURACAN).1
1. Kankersoort en lijn van behandeling
Onderhoudsbehandeling met capecitabine werd onderzocht bij patiënten met een gemetastaseerd nasopharynxcarcinoom die ten minste ziektestabilisatie hadden na eerstelijns chemotherapie bestaande uit 4 tot 6 cycli met paclitaxel, cisplatine en capecitabine (TPC).
2. Vergelijking met de referentiebehandeling in Nederland
In Nederland is het gemetastaseerd nasopharynxcarcinoom zeldzaam. Eerstelijns behandeling bestaat uit chemotherapie met gemcitabine en cisplatine gevolgd door eventueel radiotherapie op de primaire tumor en lymfeklieren in de hals. Er is geen standaard tweedelijns behandeling. In studieverband worden lokale therapieën bij oligometastasen, immuuntherapie en onder andere capecitabine toegepast. Capecitabine is niet geregistreerd voor het nasopharynxcarcinoom. Voor de Nederlandse situatie is er geen specifieke richtlijn voor het nasopharynxcarcinoom. Er wordt gebruikgemaakt van de ESMO-EURACAN-clinical practice guidelines.1 In deze richtlijn wordt geen onderhoudsbehandeling genoemd. Combinatiechemotherapie in de vorm van TPC wordt in Nederland nauwelijks voor deze indicatie toegepast. Deze behandeling vond echter plaats voor het moment van inclusie in de studie. De controlebehandeling in de studie – maximaal ondersteunde zorg – is gelijk aan de Nederlandse praktijk.
3. Methode en kwaliteit van de studie
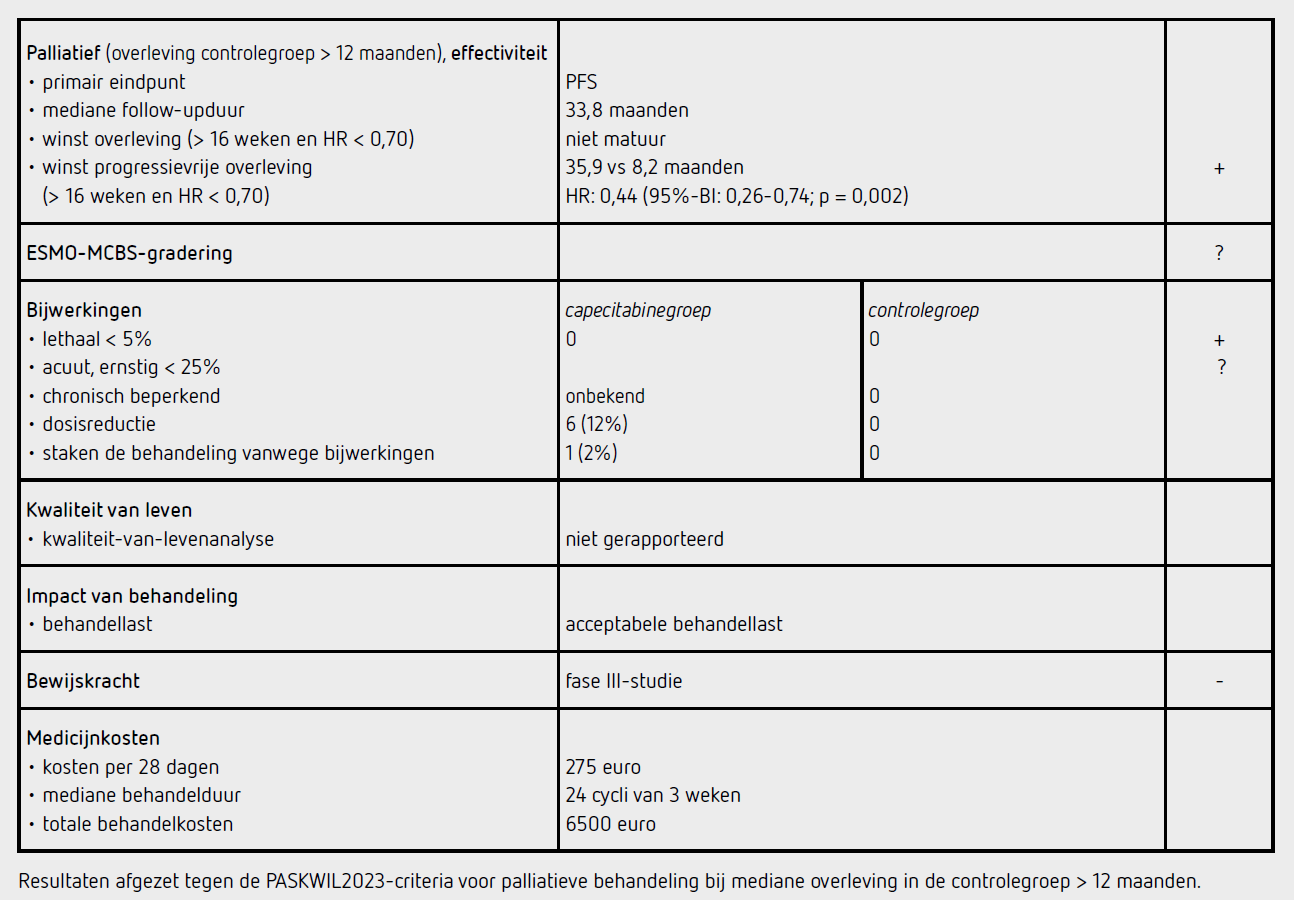
Deze gerandomiseerde klinische fase III-studie werd uitgevoerd bij het Sun Yat-sen University Cancer Center, Guangzhou, Guangdong te China.2 Patiënten met een nieuw gediagnosticeerd gemetastaseerd nasopharynxcarcinoom kregen 4 tot 6 cycli chemotherapie bestaande uit paclitaxel, 150 mg/m2 iv op dag 1, cisplatine, 60 mg/m2 iv op dag 1, en capecitabine, 1000 mg/m2 oraal tweemaal daags op dag 1 tot 14 (TPC) in een 3-wekelijks schema. Patiënten met een leeftijd tussen de 18 en 65 jaar met een WHO-performancestatus van 0 of 1, die na 4 tot 6 kuren ziektecontrole bereikten (complete respons, gedeeltelijke respons en stabiele ziekte, beoordeeld door een onafhankelijke beoordelingscommissie volgens RECIST 1.1) werden 1:1 gerandomiseerd tussen capecitabine onderhoudstherapie (1000 mg/m2 oraal tweemaal daags op dagen 1-14) elke 3 weken tot 2 jaar en maximaal ondersteunde zorg (capecitabinegroep) of alleen maximaal ondersteunde zorg (controlegroep). Er vond geen stratificatie plaats. Het primaire eindpunt van de studie was progressievrije overleving (PFS). Secundaire eindpunten waren objectief responspercentage, responsduur, overleving (OS) en veiligheid. De respons werd elke 3 maanden vastgesteld door middel van lokaal onderzoek van de nasopharynx en lymfeklieren en CT- of MRI-scan beoordeeld volgens RECIST 1.1. Op indicatie werd een PET-scan of skeletscintigrafie verricht. Kwaliteit van leven werd niet gemeten. Er moesten 104 patiënten (waarvan 98 evalueerbaar) gerandomiseerd worden om met 80 procent power en een tweezijdige alfa van 0,05 een hazard ratio (HR) van 0,55 voor PFS vast te kunnen stellen met een geschatte toename van de PFS van 6 naar 11 maanden.
4. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
Van mei 2015 tot januari 2020 werden 104 patiënten gerandomiseerd waarvan 52 toegewezen werden aan de capecitabinegroep en 52 aan de controlegroep. De deelnemende patiënten waren grotendeels man (81 procent) met een mediane leeftijd van 47 jaar. De uitgangskarakteristieken waren vergelijkbaar tussen de beide groepen. Na een mediane follow-up van 33,8 maanden was er sprake van progressie of overlijden bij 23 patiënten (44,2 procent) in de capecitabinegroep en 37 patiënten (71,2 procent) in de controlegroep.
De mediane PFS was significant langer in de capecitabinegroep (35,9 maanden [95%-BI: 20,5-niet bereikt]) dan in de controlegroep (8,2 maanden [95%-BI: 6,4-10,0 maanden]), met een HR van 0,44 (95%-BI: 0,26-0,74; p = 0,002).
Hogere objectieve responspercentages en een langere mediane responsduur werden vastgesteld in de capecitabinegroep vergeleken met de controlegroep (objectief responspercentage, 25,0% [n = 13] versus 11,5 procent [n = 6]; en mediane responsduur 40,0 maanden [95%-BI: niet bereikt-niet bereikt] vs. 13,2 maanden [95%-BI: 9,9-16,5 maanden]). Ten tijde van deze analyse waren 14 patiënten (27 procent) in de capecitabinegroep en 23 patiënten (44 procent) in de controlegroep overleden. Het verschil in OS is niet statistisch significant (HR:0,59 [95%-BI: 0,30-1,16]; p = 0,13), maar de OS is nog niet matuur.
In de capecitabinegroep waren 50 patiënten evalueerbaar voor bijwerkingen. De totale incidentie van bijwerkingen van graad 3 of hoger wordt niet vermeld. De meest voorkomende graad 3 of 4 bijwerkingen waren anemie (6 patiënten [12 procent]) en hand-voetsyndroom (5 patiënten [10 procent]). Een patiënt stopte capecitabine vanwege bijwerkingen en bij 6 patiënten was dosisaanpassing nodig. Er waren geen sterfgevallen gerelateerd aan de behandeling. In de controlegroep kwamen geen bijwerkingen van graad 3 of hoger voor, behoudens 1 patiënt met een anemie graad 4.
Discussie
In deze studie verbeterde onderhoudsbehandeling met capecitabine de mediane PFS met 28 maanden bij patiënten met een gemetastaseerd nasopharynxcarcinoom die ziektecontrole bereikten na chemotherapie in een Chinese populatie (HR: 0,44 [95%-BI: 0,26-0,74]; p = 0,002). Dit verschil voldoet voor een positief advies volgens de PASKWIL2023-criteria voor palliatieve behandeling bij studies waar de mediane overleving in de controlegroep langer dan 12 maanden is. Er is nog geen verschil in overleving aangetoond, maar deze data zijn nog niet matuur. De bijwerkingen van capecitabine waren beheersbaar. De voorbehandeling met TPC is vrij toxisch. Patiënten die deze behandeling goed hebben doorstaan zullen vermoedelijk in goede conditie zijn geweest bij diagnose. Ook mochten patiënten ouder dan 65 jaar niet in de studie worden geïncludeerd. Over de effectiviteit bij oudere kwetsbare patiënten kan dus geen uitspraak gedaan worden. Het is bekend dat de metabolisering van medicijnen in Aziatische patiënten verschilt met Kaukasische patiënten. In de studie wordt capecitabine lager gedoseerd dan in Nederland gebruikelijk is (1000 mg/m2 in plaats van 1250 mg/ m2). Ook wordt in deze studie geen DPYD-genotypering verricht, hetgeen in Nederland wel gebruikelijk is en een goede voorspeller is van ernstige toxiciteit door capecitabine. Er loopt momenteel een gecontroleerde, gerandomiseerde fase III-studie waarin TPC vergeleken wordt met gemcitabine en cisplatine bij patiënten met een gemetastaseerde nasopharynxcarcinoom (ChiCTR1900027112). Ondanks deze kanttekeningen betreffende de studiepopulatie lijkt capecitabine onderhoudsbehandeling na eerstelijns chemotherapie een zinvolle aanvulling op de behandeling te zijn.
5. Kosten
De kosten van capecitabine 1000 mg/m2 d1-14 elke 3 weken zijn bij een lichaamsoppervlak van 2 m2 184 euro per cyclus van 21 dagen. Bij een behandelduur van 2 jaar zijn de medicijnkosten in totaal ongeveer 6500 euro.
Conclusie
In de hier besproken fase III-studie wordt na een mediane follow-up van 33,8 maanden bij patiënten met primair gemetastaseerd nasopharynxcarcinoom die ziektecontrole bereikten na 4 tot 6 inductiechemotherapiekuren een significante verbetering van de PFS van 8,2 naar 35,9 maanden met een HR van 0,44 gezien van onderhoudsbehandeling met capecitabine. Dit verschil voldoet aan de criteria voor een positief advies volgens de PASKWIL2023-criteria voor palliatieve behandeling bij studies waar de mediane overleving in de controlegroep langer dan 12 maanden is.
Capecitabine werd goed verdragen en heeft een klinisch effect bij het gemetastaseerde nasopharynxcarcinoom als onderhoudsbehandeling na ziektecontrole bij eerstelijnsbehandeling.
Referenties
- Bossi P, Chan AT, Even C, Machiels JP; ESMO Guidelines Committee. Electronic address: clinicalguidelines@esmo.org. ESMO-EURACAN Clinical Practice Guideline update for nasopharyngeal carcinoma: adjuvant therapy and first-line treatment of recurrent/metastatic disease. Ann Oncol 2023;34:247-50.
- Liu GY, Li WZ, Wang DS, et al. Effect of capecitabine maintenance therapy plus best supportive care vs best supportive care alone on progression-free survival among patients with newly diagnosed metastatic nasopharyngeal carcinoma who had received induction chemotherapy: A phase 3 randomized clinical trial. JAMA Oncol. 2022;8(4):553-61.