
Inleiding
Ruim twee derde van de patiënten met een mammacarcinoom heeft hormoonreceptorpositieve (HR-positieve), humaan epidermaal groeifactorreceptor 2-negatieve (HER2-negatieve) ziekte.1 Bij patiënten met gemetastaseerd HR-positief, HER2-negatief mammacarcinoom bestaat in Nederland de standaard eerstelijnstherapie uit antihormonale therapie, gevolgd door endocriene therapie met een CDK4/6-remmer in de tweede lijn. In het geval van endocriene resistentie kan worden overgegaan op chemotherapie, waaronder een taxaan, anthracycline en capecitabine.
Sacituzumab-govitecan is een antilichaamgeneesmiddelconjugaat (ADC) dat bestaat uit een Trop-2-antilichaam, een linker en het cytotoxische SN-38. Het Trop-2-antilichaam is een gehumaniseerd IgG1-antilichaam gericht tegen het Trop-2-eiwit, dat tot expressie komt op het oppervlak van diverse solide tumoren. Het gekoppelde cytotoxische geneesmiddel is SN-38, de vele malen potentere metaboliet van irinotecan. De ratio SN-38 per antilichaam bedraagt 7,6. Dat wil zeggen dat er 7,6 moleculen SN-38 aan één Trop-2-antilichaam zijn gekoppeld. Het ADC wordt na binding aan Trop-2 in zijn geheel geïnternaliseerd en gedegradeerd door de lysosomen, waarna SN-38 vrijkomt. SN-38 werkt direct in de cel waar het geïnternaliseerd is, maar kan ook door de celwand diffunderen en zo effect hebben op de omliggende cellen (bystander effect). Sacituzumab-govitecan leidt bij patiënten met tripelnegatief gemetastaseerd mammacarcinoom tot een langere PS en OS en heeft voor deze indicatie een positief cieBOM-advies gekregen.2
De EMA heeft sacituzumab-govitecan geregistreerd voor de behandeling van patiënten met een irresectabel of gemetastaseerd HR-positief, HER2-negatief mammacarcinoom die hormoontherapie en ten minste 2 eerdere lijnen systemische therapie voor irresectabele of gemetastaseerde ziekte hebben ontvangen.
1. Kankersoort en lijn van behandeling
De fase III-studie TROPiCS-02 evalueerde sacituzumab-govitecan bij patiënten met HR-positief, HER2-negatief gemetastaseerd mammacarcinoom die progressief waren op endocriene therapie en minimaal 2 lijnen chemotherapie gehad hadden.3,4
2. Vergelijking met de referentiebehandeling in Nederland
In Nederland wordt bij patiënten met een irresectabel of gemetastaseerd HR-positief, HER2-negatief mammacarcinoom na endocriene therapie met in de tweede lijn een CDK4/6-remmer, doorgaans een taxaan- of anthracylinebevattende therapie dan wel capecitabine gegeven. In de daaropvolgende lijnen worden behandelingen met vinorelbine, gemcitabine of eribuline-mesilaat als reguliere behandelopties beschouwd. De behandeling in de controlegroep kan als gelijkwaardig aan de referentiebehandeling in Nederland worden beschouwd.
3. Methode en kwaliteit van de studie
De TROPiCS-02 is een internationale, gerandomiseerde, open-label fase III-studie. Inclusiecriteria waren irresectabel of gemetastaseerd HR-positief, HER2-negatief mammacarcinoom, progressie na minimaal 1 lijn endocriene therapie, een CDK4/6-remmer ergens in de behandeling en 2 tot 4 lijnen chemotherapie voor gemetastaseerde ziekte, waaronder in ieder geval 1 taxaan. Overige inclusiecriteria waren een leeftijd boven de 18 jaar, ECOG-performancestatus van 0 of 1 en meetbare ziekte volgens RECIST 1.1. Belangrijke exclusiecriteria waren eerdere behandeling met een topoïsomerase 1-remmer, actieve infecties, ernstig cardiaal lijden en actieve inflammatoire darmziekten.
Patiënten werden 1:1 gerandomiseerd tussen sacituzumabgovitecan (10 mg/kg intraveneus op dag 1 en dag 8 elke 21 dagen) of chemotherapie naar keuze van de behandelend arts waarbij de keuze bestond uit monotherapie met eribuline, capecitabine, gemcitabine of vinorelbine. Bij de randomisatie werd gestratificeerd voor viscerale metastasen (ja of nee), eerdere endocriene therapie voor gemetastaseerde ziekte langer dan 6 maanden (ja of nee), en aantal eerdere lijnen chemotherapie voor gemetastaseerde ziekte (2 versus 3 of 4). De therapie werd gecontinueerd tot aan ziekteprogressie, onacceptabele bijwerkingen of op verzoek van patiënt. Het was toegestaan om de behandeling na progressie te continueren als de behandelaar inschatte dat de patiënt hier baat bij had. CT- of MRI-scans werden elke 6 weken verricht gedurende de eerste 54 weken en elke 12 weken daarna, en beoordeeld volgens RECIST 1.1.
Het primaire eindpunt van de studie was progressievrije overleving (PFS) volgens onafhankelijke centrale beoordeling. Secundaire eindpunten waren totale overleving (OS), objectieve responskans (ORR), veiligheid en door patiënten gerapporteerde uitkomsten, die werden verzameld middels de vragenlijst EORTC QLQ-C30.
Trop-2-expressie in de tumoren van de patiënten werd geanalyseerd om na te gaan of dit van invloed was op de behandelingsuitkomsten.
Volgens het ontwerp van de studie waren 520 patiënten en 350 events nodig voor 92 procent power bij een tweezijdige alfa van 0,05 als voor het primaire eindpunt PFS de hazard ratio (HR) 0,70 is.2 OS zou alleen formeel worden getest als PFS statistisch significant was. Voor de geplande finale analyse van OS waren 438 events nodig voor een power van 87 procent bij een tweezijdige alfa van 0,05 als de HR 0,73 is. Volgens het studieprotocol zouden 2 interim-analyses voor OS plaatsvinden. Voor de tweede interim-analyse was gepland om bij 350 events een alfa van 0,0207 te hanteren. Omdat het werkelijke aantal events 390 was, werd de alfa voor de interim-analyse daarop aangepast en kon OS als significant worden beschouwd indien de p-waarde onder 0,0223 lag. Objectieve responskans en kwaliteit van leven zouden worden geëvalueerd als OS significant was.
4. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
Tussen mei 2019 en april 2021 werden 543 patiënten geïncludeerd: 272 patiënten in de sacituzumab-govitecangroep en 271 patiënten in de controlegroep. In de controlegroep kregen 130 (48 procent) patiënten eribuline, 63 (23 procent) vinorelbine, 56 (21 procent) gemcitabine en 22 (8 procent) capecitabine. De demografische gegevens en kenmerken van de patiënten waren over het algemeen vergelijkbaar tussen de behandelgroepen. De mediane leeftijd van de patiënten was 56 jaar en de mediane tijd vanaf de initiële diagnose van gemetastaseerde ziekte tot de randomisatie was ongeveer 48 maanden. Patiënten hadden mediaan 3 eerdere lijnen chemotherapie gekregen voor gemetastaseerde ziekte en 95 procent van de patiënten had viscerale metastasen ten tijde van inclusie (met in ongeveer 90 procent levermetastasen). 462 (95 procent) van de patiënten waar Trop-2-bepaling uitgevoerd kon worden, had aantoonbare Trop-2-expressie. Vervolgbehandelingen na progressie in de studie werden niet vermeld.
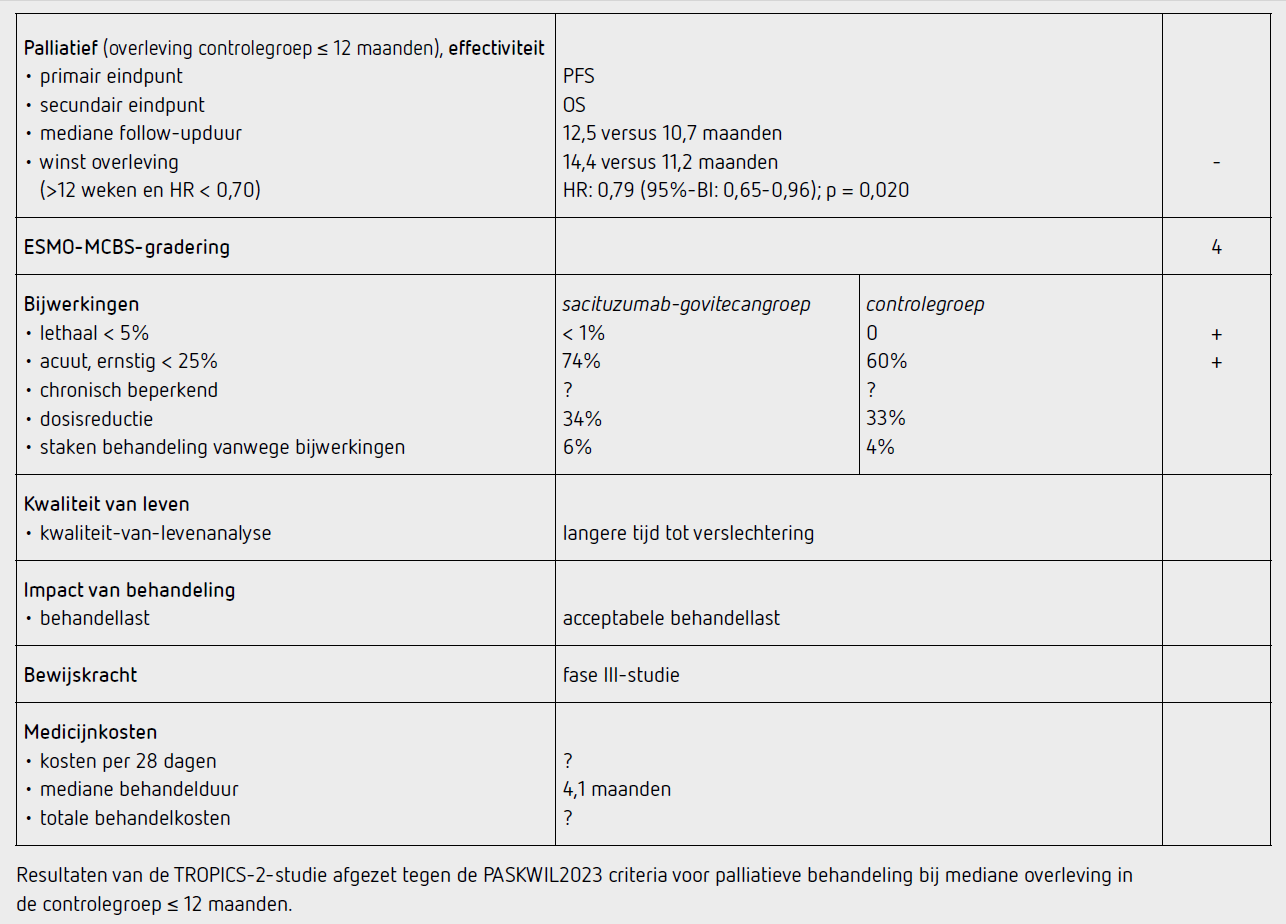
Ten tijde van de analyse voor PFS bedroeg de mediane follow-upduur 11,3 maanden in de sacituzumab-govitecangroep en 9,8 maanden in de controlegroep. De mediane PFS was 5,5 maanden (95%-BI: 4,2-7,0) in de sacituzumab-govitecangroep en 4,0 maanden (95%-BI: 3,1-4,4) in de chemotherapiegroep (HR 0,66; [95%-BI 0,53-0,83]; p = 0,0003). Bij een mediane followupduur van 12,5 maanden waren 191 patiënten in de sacituzumab-govitecangroep overleden en bij een mediane follow-upduur van 10,7 maanden waren 199 patiënten in de controlegroep overleden. De behandeling met sacituzumab-govitecan resulteerde in een significant voordeel in OS in vergelijking met chemotherapie met een verbetering van de mediane OS van 3,2 maanden (HR: 0,79 [95%-BI: 0,65-0,96]; p = 0,020). Mediane OS was 14,4 maanden (95%-BI: 13,0-15,7) in de sacituzumab-govitecangroep en 11,2 maanden (95%-BI:10,1-12,7) in de controlegroep. Dit OS voordeel werd waargenomen in verschillende subgroepen van patiënten en was onafhankelijk van aantal eerdere lijnen van chemotherapie of niveau van Trop-2-expressie. De mediane behandelduur was 4,1 maanden in de sacituzumab-govitecangroep en 2,3 maanden in de chemotherapiegroep. De hier beschreven OS-data met 390 events betreft de geplande tweede interim-analyse (gepland bij 350 events). Vanwege het gevonden statistisch significant voordeel in OS wordt dit de finale analyse.
Kwaliteit-van-levenanalyse liet een voordeel zien voor de sacituzumab-govitecangroep ten opzichte van de controlegroep met een langere tijd tot verslechtering van kwaliteit van leven (4,3 versus 3,0 maanden; HR: 0,75 [95%-BI: 0,61-0,92]; p = 0,0059) en een langere tijd tot toename van moeheid (2,2 versus 1,4 maanden; HR: 0,73 [95%-BI: 0,60-0,89]; p = 0,0021). De mediane tijd tot toename van pijn was in beide groepen vergelijkbaar (3,8 versus 3,5 maanden; HR: 0,92 [95%-BI: 0,75 1,13]; p = 0,42).
Bijna alle patiënten in de sacituzumab-govitecangroep (99 procent) en de meerderheid in de controlegroep (92 procent) kregen de toegewezen behandeling. Bijwerkingen van graad 3 en hoger kwamen voor bij 198 patiënten (74 procent) in de sacituzumab-govitecangroep en bij 150 patiënten (60 procent) in de controlegroep. Dit leidde bij 17 patiënten (6 procent) in de sacituzumab-govitecangroep en bij 11 patiënten (4 procent) in de controlegroep tot staken van de behandeling. Eén patiënt in de sacituzumab-govitecangroep overleed ten gevolge van de behandeling (septische shock ten gevolge van neutropene colitis). De meest voorkomende behandelinggerelateerde bijwerkingen van graad 3 of hoger waren neutropenie (51 procent versus 38 procent), diarree (9 procent versus 1 procent), anemie (6 procent versus 3 procent) en vermoeidheid (6 procent versus 3 procent). Er werden geen gevallen van pneumonitis gerapporteerd.
Van de patiënten die met sacituzumab-govitecan behandeld werden, hadden 103 patiënten (38 procent) een wildtype UGT1A1-genotype, 119 (44 procent) waren heterozygoot en 25 patiënten (9 procent) hadden een homozygoot genotype. In de groep van patiënten met een homozygoot genotype kwam meer graad 3 neutropenie en diarree voor, maar deze subgroep was erg klein.
Discussie
De TROPiCS-02-studie toont een langere OS in de sacituzumab-govitecangroep in vergelijking met de controlegroep (HR: 0,79 [95%-BI: 0,65-0,96]; p = 0,020) bij patiënten met HR-positief, HER2-negatief irresectabel of gemetastaseerd mammacarcinoom. Mediane OS was 14,4 maanden (95%-BI: 13,0-15,7) in de sacituzumab-govitecangroep en 11,2 maanden (95%-BI: 10,1-12,7) in de controlegroep. De resultaten van dit eindpunt voldoen niet aan de PASKWIL2023-criteria voor een positief advies voor palliatieve behandeling bij studies waar de mediane overleving in de controlegroep 12 maanden of korter is.
De behandeling in de controlegroep bestond uit chemotherapie naar keuze van de behandelaar (eribuline, capecitabine, gemcitabine, vinorelbine) wat overeenkomt met de huidige praktijk in Nederland. In de controlegroep startten 22 patiënten (8 procent) niet met de behandeling, tegenover 4 patiënten (2 procent) in de sacituzumab-govitecangroep, wat de resultaten mogelijk gering beïnvloed heeft. De effectiviteit van sacituzumab-govitecan was vrij consistent over de vooraf gedefinieerde subgroepen en onafhankelijk van de Trop-2-expressie. Bijwerkingen in de sacituzumab-govitecangroep waren niet duidelijk verschillend van de controlegroep, behoudens vaker graad 3 of hoger neutropenie en diarree (51 procent versus 38 procent en 9 procent versus 1 procent, respectievelijk). Pneumonitis, een bijwerking die frequent beschreven is bij andere ADC’s, werd in deze studie niet waargenomen.
Kosten
De kosten van deze behandeling zijn nog niet bekend.
Conclusie
Bij patiënten met een HR-positief, HER2-negatief irresectabel of gemetastaseerd mammacarcinoom leidt behandeling met sacituzumab-govitecan na 2-4 eerdere lijnen chemotherapie tot een verbetering van de mediane OS van 11,2 naar 14,4 maanden ten opzichte van chemotherapie (HR: 0,79 [95%-BI: 0,65-0,96]; p = 0,020). De resultaten van dit eindpunt voldoen niet aan de PASKWIL2023-criteria voor een positief advies voor palliatieve behandeling bij studies waar de mediane overleving in de placebogroep 12 maanden of korter is.
Referenties
- Nederlandse Kankerregistratie (cijfersoverkanker.nl). Integraal Kankercentrum Nederland.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Sacituzumab govitecan bij het irresectabel of gemetastaseerd tripelnegatief mammacarcinoom. Med Oncol 2022;25(2):23-7.
- Rugo HS, Bardia A, Marmé F, et al. Sacituzumab govitecan in hormone receptor-positive/ human epidermal growth factor receptor 2-negativemetastatic breast cancer. J Clin Oncol 2022; 40:3365-76.
- Rugo HS, Bardia A, Marmé F et al. Overall survival with sacituzumab govitecan in hormone receptor-positive and human epidermal growth factor receptor 2-negative metastatic breast cancer (TROPiCS-02): a randomised, open-label, multicentre, phase 3 trial. Lancet 2023;402(10411):1423-33.