Inleiding
De incidentie van het niercelcarcinoom is in Nederland nde laatste decennia sterk toegenomen: van 1.300 diagnoses in 1990 naar bijna 2.700 in 2021.1 Mede door bredere inzet van beeldvorming wordt nierkanker vaker vroeg gediagnosticeerd en is de 10-jaarsoverleving gestegen tot bijna 60 procent. Toch overlijden in Nederland jaarlijks bijna 1.000 patiënten aan nierkanker. Nierkanker in stadium II, stadium III en stadium IV wordt respectievelijk bij 9, 13 en 19 procent van de patiënten gediagnosticeerd. De behandelmogelijkheden bij het gevorderd of gemetastaseerd niercelcarcinoom zijn met TKI’s (VEGFR-remmers) en met checkpointremmers in de laatste 10 jaar sterk toegenomen. Meerdere TKI’s zijn onderzocht als adjuvante behandeling na resectie van heldercellig niercelcarcinoom met een hoog risico op een recidief. Ze bleken onvoldoende effectief en te veel bijwerkingen (of beide) te hebben om behandeling hiermee te kunnen rechtvaardigen.2 Momenteel worden meerdere checkpointremmers in de adjuvante setting onderzocht. In de hier te bespreken KEYNOTE-564-studie wordt adjuvante behandeling met pembrolizumab vergeleken met placebo bij patiënten met een gereseceerd heldercellig niercelcarcinoom met een hoog risico op een recidief.3 De EMA heeft pembrolizumab geregistreerd voor de behandeling van volwassen patiënten met niercelcarcinoom met een verhoogd risico op een recidief na nefrectomie of na nefrectomie en resectie van metastasen.
1. Kankersoort en lijn van behandeling
Adjuvant pembrolizumab werd onderzocht bij patiënten met een heldercellig niercelcarcinoom na radicale chirurgische resectie waarbij een hoog risico op recidief bestond.
2. Vergelijking met de referentiebehandeling in Nederland
In Nederland wordt aan patiënten met een niercelcarcinoom geen systemische adjuvante behandeling na nefrectomie of partiële nefrectomie gegeven. De standaardarm in deze studie voldoet hiermee aan de referentiebehandeling in Nederland.
3. Methode en kwaliteit van de studie
KEYNOTE-564 is een dubbelblind gerandomiseerde fase III-multicenterstudie voor patiënten met een volledig gereseceerd, histologisch bewezen heldercellig niercelcarcinoom met een hoog risico op een recidief bij wie sprake was van een stadium II-tumor van graad 4 of sarcomatoïde weefselceltype, stadium III met locoregionale lymfekliermetastasen of stadium IV-ziekte. In het geval van stadium IV-niercelcarcinoom moest het om radicaal verwijderde synchrone of metachrone metastase(n) in de weke delen gaan. Om voor inclusie in aanmerking te komen dienden patiënten 18 jaar of ouder te zijn, een ECOG-performancestatus van 0 of 1 te hebben en goede orgaanfuncties. Patiënten mochten geen eerdere systemische behandeling voor niercelcarcinoom hebben gehad en de nefrectomie of partiële nefrectomie moest binnen 12 weken voor randomisatie uitgevoerd zijn. In het geval van resectie van een solitaire (viscerale) metastase moest de primaire tumor minder dan 12 maanden ervoor verwijderd zijn.
De volgende patiëntencategorieën werden geëxcludeerd: tweede kanker met behandelindicatie, andere grote chirurgische ingreep binnen 12 weken voor randomisatie, eerdere radiotherapie voor niercelcarcinoom, symptomatische metastasen in het centraal zenuwstelsel, actieve autoimmuunziekten, persisterende trombus in de vena renalis of vena cava inferior na operatie, actieve infectie waarvoor behandeling nodig is, actieve virale hepatitis, hiv-infectie en immuundeficiëntie of actieve behandeling met immunosuppressiva of steroïden (gelijkwaardig aan > 10 mg prednisolon per dag).
Patiënten werden 1:1 gerandomiseerd tussen behandeling met pembrolizumab en placebo. De behandeling werd gestratificeerd naar wel of geen metastasen (M0 versus M1 no evidence of disease [NED]). Vervolgens werd de groep zonder metastasen (M0) gestratificeerd voor ECOG-performancestatus (0 versus 1) en geografische regio (Noord-Amerika versus rest van de wereld).
De ziektevrije status werd beoordeeld door de onderzoeker met een CT- of MRI-scan en een botscan voorafgaand aan randomisatie. De beeldvorming werd later geverifieerd door het studieteam. De pembrolizumabdosering was 200 mg en werd iedere 3 weken i.v. toegediend. Dosisreductie werd niet toegestaan, maar uitstel was mogelijk. De behandeling werd gestaakt bij ziekteprogressie, klinische verslechtering van de conditie van de patiënt, om veiligheidsredenen, vanwege het starten van een andere oncologische behandeling of bij het intrekken van toestemming. Pembrolizumab werd voor een maximale duur van 17 cycli gegeven. Crossover was niet toegestaan.
Het primaire eindpunt van de studie was ziektevrije overleving (DFS), gedefinieerd als tijd tussen randomisatie en het optreden van een lokaal recidief, metastasen op afstand of overlijden. Secundaire eindpunten waren overleving (OS), lokale ziektevrije overleving (DRSS1), metastasevrije overleving (DRSS2), DFS en OS afhankelijk van PD-L1-expressie, veiligheid van de behandeling en kwaliteit van leven.
Effectiviteit werd getest in de intentionto-treatpopulatie en veiligheid werd getest in alle behandelde patiënten. Bijwerkingen van de behandeling werden geëvalueerd volgens CTC-AE 4.0. Tumormeting werd gedaan met een CT- of MRI-scan en botscan bij start, vervolgens iedere 12 weken gedurende het eerste jaar, daarna voor jaar 2, 3 en 4 iedere 16 weken en nadien iedere 24 weken of tot ziekterecidief, start nieuwe behandeling of intrekken van toestemming. Kwaliteit van leven werd als exploratief eindpunt geanalyseerd met behulp van de NCCN-vragenlijst Functional Assessment of Cancer Therapy Kidney Symptom Index- Disease-Related Symptoms (FKSI-DRS) en de European Organization for Research and Treatment of Cancer (EORTC) Qualityof-Life Questionnaire (QLQ-C30).
In het ontwerp van de studie waren er 990 patiënten en 332 events (ziekterecidief of overlijden) nodig om met 95 procent power en een eenzijdige alfa van 0,025 een hazard ratio (HR) van 0,67 voor ziekterecidief of overlijden vast te kunnen stellen. Dit zou resulteren in een DFS-verlenging van ongeveer 22 maanden; van de verwachte 45 maanden in de placebogroep naar 67 maanden in de pembrolizumabgroep. Er werd gebruikgemaakt van de gestratificeerde logranktest voor de verschillen tussen de behandelgroepen; DFS en OS werden met de Kaplan-Meier-methode geëvalueerd en HR en 95%-betrouwbaarheidsinterval (95%-BI) werden geschat middels een Coxregressiemodel. Het primaire eindpunt DFS en het secundaire eindpunt OS werden hiërarchisch geanalyseerd. Als de analyse voor DFS significant was, dan kon OS geanalyseerd worden. Voor DFS voorzag het protocol in één interim-analyse na 265 events (80 procent) en 3 interimanalyses voor OS na ongeveer 47, 66 en 86 procent van het beoogde aantal OSevents (200), en een finale analyse voor OS. De finale analyse voor het primaire eindpunt DFS en de tweede interim-analyse voor OS zal plaatsvinden 48 maanden na randomisatie van de eerste patiënt. De in dit artikel gerapporteerde data zijn afkomstig van de eerste interim-analyse voor DFS en de eerste interim-analyse voor OS. De grens voor een statistisch significante DFS bij deze interim-analyse is P = 0,0114 (eenzijdig).
4. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
Tussen juni 2017 en september 2019 werden 1.406 patiënten gescreend door 213 centra in 21 landen. Uiteindelijk werden 994 patiënten geïncludeerd: 496 patiënten in de pembrolizumabgroep en 498 patiënten in de placebogroep. Op het moment van de analyse van het primaire eindpunt (december 2020) bedroeg de mediane follow-up 24,1 maanden (range: 14,9-41,5). De uitgangskarakteristieken in de beide behandelgroepen waren vergelijkbaar: de mediane leeftijd was 60 jaar, ongeveer 70 procent van de patiënten was man, 85 procent had een ECOG-performancestatus van 0 en 92,5 procent had een radicale nefrectomie ondergaan. De verdeling op basis van etniciteit werd niet weergegeven, maar ongeveer 26 procent van de patiënten kwam uit de Verenigde Staten en 38 procent uit West-Europa. In de pembrolizumabgroep en de placebogroep had respectievelijk 89,5 en 87,8 procent een pT3-tumor, 44,2 en 42,8 procent was graad 3, 20,8 en 23,9 procent was graad 4 en 10,5 en 11,8 procent hadden een sarcomatoïde tumortype. In beide groepen ging het om M0-ziekte bij 94,2 procent van de patiënten. In beide behandelgroepen hadden 29 patiënten (5,8 procent) voorafgaand een metastasectomie ondergaan. De metastasen zaten in een bijnier (9 versus 13), long (8 versus 3) en lymfeklieren (2 versus 5). Bij respectievelijk 73,6 en 76,9 procent van de patiënten had het niercelcarcinoom een PD-L1-expressie met een combined positive score (CPS) van 1 of hoger.
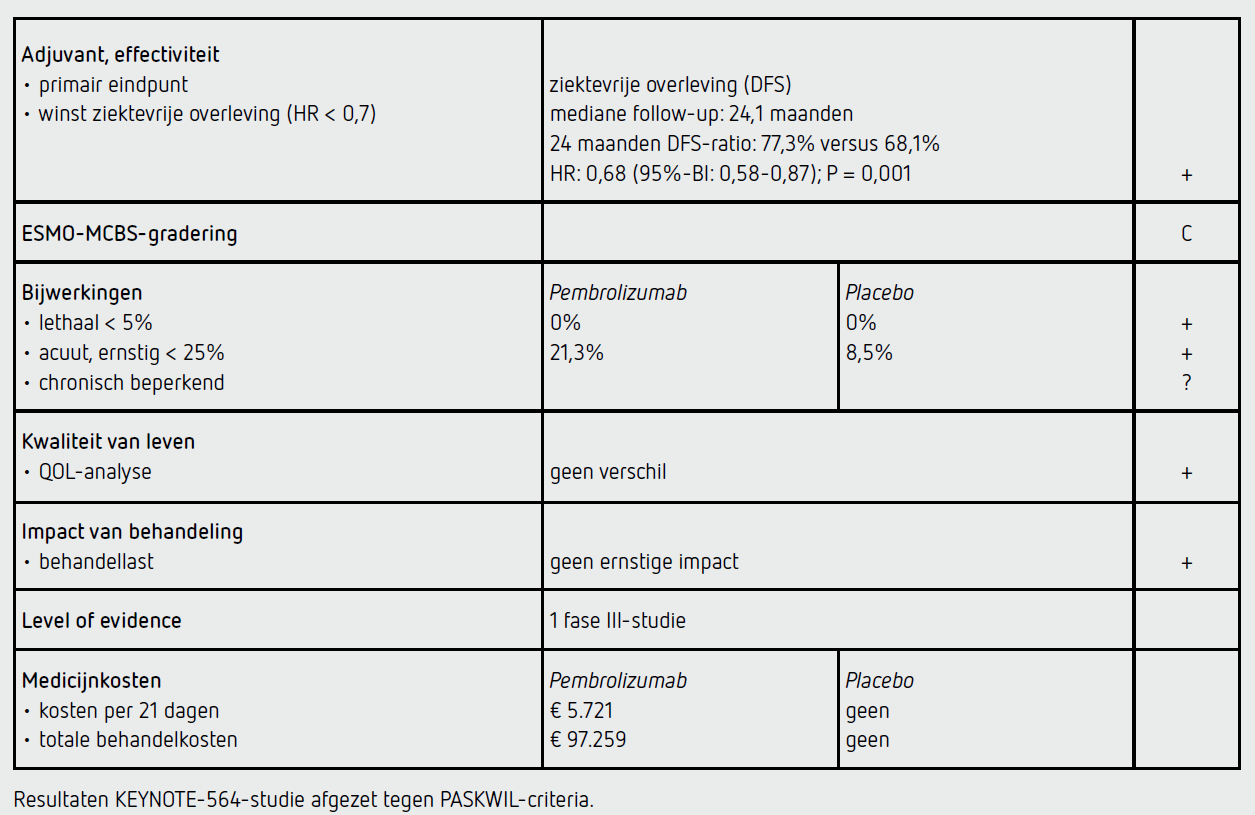
Het primaire eindpunt DFS was significant beter in de pembrolizumab-groep dan in de placebogroep (HR: 0,68 [95%-BI: 0,53-0,87]; P = 0,002). De mediane DFS werd in beide groepen niet bereikt. De geschatte 2-jaars ziektevrije overleving bedroeg 77,3 procent (95%-BI: 72,8-81,1) in de pembrolizumab-groep en 68,1 procent (95%-BI: 63,5-72,2) in de placebogroep (Δ 9,2 procent). Het DFS-voordeel voor pembrolizumab werd gezien in meerdere geplande subgroepanalyses, maar het verschil was in het algemeen klein en het betrouwbaarheidsinterval groot door een beperkt aantal events.
Een lokaal recidief trad op bij 17 patiënten (3,4 procent) in de pembrolizumab-groep en bij 32 patiënten (6,4 procent) in de placebogroep. Metastasen op afstand zijn bij 86 patiënten (17,3 procent) en 117 patiënten (23,5 procent) vastgesteld in respectievelijk de pembrolizumab-groep en placebogroep. In totaal waren 51 patiënten overleden: 18 in de pembrolizumab-groep en 33 in de placebogroep. De mediane OS was in beide groepen nog niet bereikt. De geschatte 2-jaarsoverleving bedroeg 96,6 procent (95%-BI: 94,3-98,0) in de pembrolizumabgroep en 93,5 procent (95%-BI: 90,5-95,6) in de placebogroep (Δ 3,1 procent) met een nietsignificante HR voor overlijden van 0,54 (95%-BI: 0,30-0,96).
Van de 496 patiënten in de pembrolizumab-groep ontvingen 488 patiënten ten minste één cyclus; hiervan staakten 190 patiënten (38,9 procent) de behandeling voortijdig. Bij 21,3 procent werd de behandeling gestaakt vanwege bijwerkingen – ALAT-/ASAT-stijging (12 procent), bijnierschorsinsufficiëntie (5 procent), colitis (5 procent) en nierfunctieverlies (4 procent) – en bij 10,5 procent vanwege ziekterecidief. Van de 498 patiënten in de placebogroep ontvingen 496 patiënten ten minste één cyclus; hiervan staakten 130 patiënten (26,2 procent) de behandeling voortijdig, waaronder 20,4 procent vanwege ziekterecidief. Het mediane aantal cycli in beide groepen was 17 en de mediane behandelduur was 11,1 maanden (range: 0-14,3) in de pembrolizumabgroep en 11,1 maanden (range: 0-15,4) in de placebogroep. Van de 76 patiënten in de pembrolizumabgroep die een vervolgbehandeling kregen, bestond deze bij 82,9 procent uit systeembehandeling, waarvan 18,4 procent een PD-(L)1-remmer en 73,7 procent een VEGF-gerichte behandeling kreeg. Van de 112 patiënten in de placebogroep die een vervolgbehandeling kregen, bestond deze bij 76,8 procent uit een systeembehandeling, waarvan 41,1 procent een PD-(L)1- remmer en 67,9 procent een VEGF-gerichte behandeling kreeg.
In totaal hadden 158 patiënten (32,4 procent) van de 488 patiënten behandeld met pembrolizumab en 88 patiënten (17,7 procent) van de 496 patiënten behandeld met placebo ten minste één bijwerking van graad 3 of hoger. In de pembrolizumab-groep zijn geen patiënten overleden aan bijwerkingen van de behandeling. De meest voorkomende bijwerkingen van graad 3 of hoger in de pembrolizumabgroep waren diarree (1,6 procent), moeheid (1,0 procent) en huiduitslag (0,8 procent). De meest voorkomende aan immuuntherapie gerelateerde bijwerkingen van graad 3 of hoger (totaal 8,5 procent) waren diabetes mellitus type 1 (1,8 procent), huidreactie (1,6 procent), bijnierinsufficiëntie (1,2 procent), diarree/colitis (1,0 procent), pneumonitis (0,8 procent), hypofysitis (0,4 procent) en thryreoïditis (0,4 procent). In totaal kreeg 7,4 procent van de patiënten in de pembrolizumab-groep een hoge dosis glucosteroïden (40 mg of meer per dag) als behandeling voor immuuntherapiegerelateerde bijwerkingen.
De kwaliteit van levenanalyse liet een vergelijkbare score in beide groepen zien bij baseline. Tijdens en tot het einde van de behandeling (52 weken) kon de kwaliteit van leven bij meer dan 60 procent van de patiënten geëvalueerd worden en waren de resultaten tussen de behandelgroepen vergelijkbaar.
Discussie
In de gerandomiseerde, dubbelblinde, fase III-multicenterstudie KEYNOTE-564 wordt een statistisch significant voordeel aangetoond voor het primaire eindpunt DFS na adjuvante behandeling met pembrolizumab ten opzichte van placebo, bij patiënten met een heldercellig niercelcarcinoom bij wie er sprake was van een radicale resectie met een hoog risico op een recidief (HR: 0,68 [95%-BI: 0,53-0,87]; P = 0,001). De resultaten van dit eindpunt voldoen aan de PASKWIL-criteria voor adjuvante studies voor een voorlopig positief advies in afwachting van overlevingsdata na langere follow-up.
De prognose van de 5-jaars-DFS verschilt behoorlijk in de studiepopulatie. Bij patiënten met stadium II-ziekte is deze 80 procent, terwijl dit 20 procent is bij patiënten met een stadium IV-niercelcarcinoom. Het DFS-voordeel voor pembrolizumab werd gezien in meerdere geplande subgroepanalyses, maar het verschil was in het algemeen klein en het betrouwbaarheidsinterval groot door een beperkt aantal events. Toch lijkt het DFS-voordeel consequent toe te nemen naarmate het risico op recidief groter is, gebaseerd op T-stadium, Fuhrman-graad en M1-NED-status. Het aantal patiënten met metastasen was klein (29 patiënten in beide = groepen), waarbij slechts bij 2 patiënten (1 in beide groepen) twee metastasen gereseceerd waren.
De supplementaire data laten zien dat het kleine maar significante verschil in DFS toeneemt bij langere follow-up van 12, 18 en 24 maanden. Recentelijk zijn resultaten na een mediane follow-up van 30,1 maanden gepresenteerd, die in lijn zijn met de gepubliceerde analyse.4
Adjuvante behandeling met pembrolizumab resulteert mogelijk ook in een verbeterde 2-jaarsoverleving (96,6 versus 93,5 procent) bij een nog laag aantal events statistisch nietsignificante HR voor overlijden van 0,54 (95%-BI: 0,30- 0,96). De zeer korte follow-up maakt dat de mediane OS nog niet bereikt is.
Een groot deel van de patiënten met ziekterecidief, lokaal of op afstand, kreeg een vervolgbehandeling aangeboden. Zoals te verwachten was kregen patiënten minder vaak een PD-(L)1-remmer na pembrolizumab (18,4 versus 41,1 procent) maar vergelijkbaar vaak een VEGF-remmer (73,7 versus 67,9 procent). Als de follow-up langer wordt, dan is te verwachten dat nog meer patiënten in de placebogroep een behandeling met een PD-(L)1-remmer zullen krijgen. Dit kan de overleving beïnvloeden.
Het in deze studie beschreven bijwerkingenprofiel van pembrolizumab komt overeen met wat bekend is van andere studies. De behandeling wordt over het algemeen goed verdragen en de bijwerkingen zijn hanteerbaar. Toch moest ruim 20 procent van de patiënten vanwege bijwerkingen de behandeling vroegtijdig staken. De kwaliteit van levenanalyse suggereert een acceptabele behandellast gedurende de 12 maanden van adjuvante behandeling.
De KEYNOTE-564-studie vergelijkt adjuvant pembrolizumab gedurende 1 jaar met placebo, overeenkomstig met de geldende Nederlandse standaard. KEYNOTE-564 is de eerste studie met een PD-(L)1-remmer in deze populatie, maar het is te verwachten dat de komende jaren data van meerdere studies met verschillende PD-(L)1-remmers in deze setting beschikbaar komen. Deze data en een langere follow-up van de KEYNOTE-564-studie zal de exacte waarde van een adjuvante behandeling duidelijker kunnen maken.
Adjuvante behandeling met pembrolizumab na radicale resectie van een heldercellig niercelcarcinoom met een hoog risico op een recidief resulteert in betere DFS ten koste van meer behandellast, kosten en bijwerkingen. Voor het heldercellig niercelcarcinoom is DFS niet gevalideerd als een surrogaateindpunt voor OS en gezien de hoge number needed to treat van 33 ter voorkoming van 1 overlevingsevent bij 2 jaar, waarvan 1 jaar opgaat aan de behandeling, kan men zich afvragen of adjuvante behandeling met pembrolizumab op dit moment ingezet moet gaan worden.
Met het huidige aantal behandelopties in het geval van gemetastaseerd heldercellig niercelcarcinoom is het ook nog de vraag of een vroege inzet van pembrolizumab tot klinisch significante betere overleving gaat leiden. Deze overwegingen moeten worden meegenomen in de afweging om alle patiënten na radicale resectie met een hoog risico op een gerecidiveerd niercelcarcinoom adjuvante behandeling met pembrolizumab aan te gaan bieden. Daarbij heeft de EMA pembrolizumab in de adjuvante setting geregistreerd zonder specificatie van het histologische subtype, terwijl in de studie alleen patiënten met een (component) heldercellig niercelcarcinoom geïncludeerd zijn.
5. Kosten
De behandeling met pembrolizumab 200 mg kost 5.721 euro per behandelcyclus van 21 dagen (bron: medicijnkosten.nl d.d. 11 maart 2022). De mediane behandelduur is 1 jaar (17 cycli). De totale medicatiekosten komen daarmee op 97.259 euro per patiënt.
Conclusie
In de hier besproken KEYNOTE-564-studie wordt bij een radicaal gereseceerd heldercellig niercelcarcinoom met een hoog risico op een recidief, na een follow-up van mediaan 24,1 maanden, een statistisch significant langere DFS gezien bij de patiënten in de groep die 12 maanden adjuvante behandeling met pembrolizumab kregen (HR: 0,68 [95%-BI: 0,53-0,87]; P = 0,002). Pembrolizumab wordt over het algemeen goed verdragen, maar toch moest ruim 20 procent van de patiënten de behandeling vroegtijdig staken vanwege bijwerkingen. De huidige resultaten voldoen aan de criteria voor een voorlopig positief advies volgens de PASKWIL-criteria voor adjuvante behandeling. Zodra mature OS-gegevens bekend worden, zullen deze door de commissie BOM worden beoordeeld en zal de commissie een definitief advies vaststellen. Er is voor deze behandeling sprake van zeer hoge kosten: ongeveer 100.000 euro per patiënt
Referenties
- Nederlandse Kankerregistratie (cijfersoverkanker.nl).
- Sun M, Marconi L, Eisen T, et al. Adjuvant vascular endothelial growth factor targeted therapy in renal cell carcinoma: a systematic review and pooled analysis. Eur Urol 2018;74(5):611-20. DOI: 10.1016/j.eururo.2018.05.002
- Choueiri TK, Tomczak P, Park SH, et al; KEYNOTE564 Investigators. Adjuvant pembrolizumab after nephrectomy in renal-cell carcinoma. N Engl J Med 2021;385(8):683-94. DOI: 10.1056/NEJMoa2106391
- Choueiri TK, Tomczak P, Park SH, et al. Pembrolizumab as post nephrectomy adjuvant therapy for patients with renal cell carcinoma: Results from 30-month follow-up of KEYNOTE564. J Clin Oncol 2022;40(6 suppl):290. DOI: 10.1200/JCO.2022.40.